|
高中化学必备知识点《磷及其化合物》答题技巧(2017年最新版)(六)
2017-08-26 02:43:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列转变过程属于氮的固定的是
A.氨气和HCl气体混合生成NH4Cl固体
B.氨的催化氧化
C.工业上用N2和H2 合成氨
D.NO遇到空气变为红棕色
参考答案:C
本题解析:游离态的N转化为化合态的N的过程,是氮的固定,所以选项C正确,答案选C。
点评:该题是基础性试题的考查,难度不大。该题的关键是记住氮的固定原理,属于常识性知识的巩固与训练,学生不难得分。
本题难度:简单
2、实验题 化学实验要符合“绿色化学”理念。某实验小组对“铜与浓硝酸反应”进行了探究性实验。试回答下列问题:

(1)写出铜和浓硝酸反应的离子方程式:?。
(2)与装置Ⅰ相比,装置Ⅱ的优点是?,装置Ⅲ除具有装置Ⅱ的优点外,还有的优点是?。
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹 ,再打开弹簧夹 ;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是 。
A.颜色
B.质量
C.气体的平均相对分子质量
D.密度
| E.压强
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是?。
参考答案:(1)Cu+4H++2N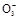  Cu2++2NO2↑+2H2O Cu2++2NO2↑+2H2O
(2)无氮的氧化物逸出,避免了对空气的污染 可控制反应随时进行,随时停止
(3)c ab BD
(4)关闭a和c,打开b,继续对烧瓶水浴加热,待气体不再放出时关闭b,停止加热,打开c
本题解析:(2)比较三种装置的结构,结合本实验原理,装置Ⅱ比装置Ⅰ优越的地方有:无氮的氧化物逸出,避免了对空气的污染;装置Ⅲ的优点还有:可控制反应随时进行,随时停止。
(3)若要让NO2充满烧瓶,需要关闭开关c、打开a和b;由于在烧瓶中存在2NO2(g) N2O4(g) ΔH<0,在沸水中,平衡左移,颜色加深、气体平均相对分子质量减小,压强增大,但是混合气体的质量和密度不变。 N2O4(g) ΔH<0,在沸水中,平衡左移,颜色加深、气体平均相对分子质量减小,压强增大,但是混合气体的质量和密度不变。
(4)若要让烧杯中的水进入烧瓶,则应减小烧瓶内的气压,所以可采取措施:关闭a和c,打开b,对烧瓶水浴
加热,则一部分NO2气体进入NaOH溶液进行反应,再降温,则烧瓶中气压会减小,此时打开c,关闭b,水即进入烧瓶。
本题难度:一般
3、填空题 已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀)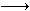 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表: 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
硝酸体积(mL)
| 100
| 200
| 300
| 400
| 剩余固体(g)
| 18.0
| 9.6
| 0
| 0
| 放出气体的体积(mL)
| 2240
| 4480
| 6720
| ?
|
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
参考答案:(本题共16分)
(1)? 4?(2分)?(2)? 1.26?(2分)
(3)? 3Fe+8H++2NO3-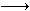 3Fe3++2NO↑+4H2O?(2分)? 16.8?(2分) 3Fe3++2NO↑+4H2O?(2分)? 16.8?(2分)
(4)? 2∶1?(2分)?(5)? 1.20?(3分)?(5)? 7840?(3分)
本题解析:略
本题难度:困难
4、选择题 已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
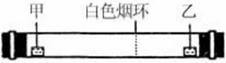
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
参考答案:C
本题解析:由气体的摩尔质量越小,扩散速度越快,所以氨气的扩散速度比氯化氢快,氨气比浓盐酸离烟环远,所以甲为浓氨水、乙为浓盐酸,故选C。
本题难度:一般
5、计算题 (12分)(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为___________________________________
②若铜有剩余,则反应将要结束时的反应的离子方程式是?。
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_____________________________________________________。
(2) 在100mL混合酸中,c(HNO3) = 0.4mol·L-1,c(H2SO4) = 0.2mol·L-1,向其中加入2.56g铜粉,微热,待充分反应后,溶液中Cu2+的物质的量浓度为?。
(3)14g铜银合金与过量的某浓度的硝酸溶液反应,待放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是?。
参考答案:(12分)
(1)① Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O (2分)
②3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O(2分)
③再加入稀H2SO4,H+与NO3―构成了氧化条件。(2分)
(2)0.15mol·L-1?(3分)
(3)3.2g(3分)
本题解析:(1)铜与硝酸反应与其浓度有关:
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(稀)="3" Cu(NO3)2 + 2NO↑ + 4H2O
③待反应停止后,再加入少量的25%的稀硫酸提供H+,溶液中的NO3-可继续氧化铜
(2)NO3-、H+、Cu均为0.04mol,结合下面的离子方程式:
3Cu ?+ ?8H+?+?2NO3- =3Cu2+ + 2NO↑ + 4H2O
0.015mol? 0.04mol? 0.01mol? 0.015mol
溶液中Cu2+的物质的量浓度为0.15mol·L-1
(3)设合金中铜为x mol,银为 y mol
由合金质量可知:64x+108y=14?由电子守恒可得:2x+y=4×11.2/22.4
x=0.05mol? y=0.1mol
所以铜为3.2g
本题难度:一般
|