微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr
CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如表.
物质
数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸
密度/g?cm-3
0.79
1.46
2.2
0.71
1.84
熔点(℃)
-130
-119
9
-116
10
沸点(℃)
78.5
38.4
132
34.6
338
在水中的溶解度(g/100g水)
互溶
0.914
1
7.5
互溶
|
请回答下列问题.
(1)加入药品之前须做的操作是:______,实验进行的途中若发现未加入碎瓷片,其处理的方法是______.
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是______.温度计的温度应控制在______之间.
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是______,______,此操作可在______(填写玻璃仪器名称)中进行,同时进行分离.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了______.
(5)粗产品中含有的主要有机液体杂质是______,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______操作.
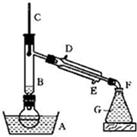
参考答案:(1)实验室制备溴乙烷,用95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末为原料,反应中有气体生成,且乙醇易挥发,所以在加入药品之前应进行的操作是:检查装置的气密性;碎瓷片能防止液体爆沸,实验进行的途中若发现未加入碎瓷片,不能再进行继续实验,也不能立即加入碎瓷片,需冷却后重新进行操作,
故答案为:检查装置的气密性;待冷却后重新进行操作;
(2)装置B的作用使乙醇蒸气回流到烧瓶中继续反应,溴乙烷的沸点为38.4℃,乙醇的沸点为78.5℃,让溴乙烷蒸发出,让乙醇冷凝回流,所以温度计的温度应控制在38.4℃~78.5℃,
故答案为:冷凝回流;38.4℃~78.5℃;
(3)二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式是:SO2+2NaOH═Na2SO3+H2O,离子反应为:SO2+2OH-=SO32-+H2O,溴能和氢氧化钠反应:Br2+2NaOH═NaBr+NaBrO+H2O,离子反应为:Br2+2OH-=Br-+BrO-+H2O,分离不互溶的有机物和无机物,用分液漏斗进行操作,
故答案为:SO2+2OH-=SO32-+H2O;Br2+2OH-=Br-+BrO-+H2O;分液漏斗;
(4)浓硫酸具有强氧化性,能氧化溴化氢,同时浓硫酸溶于水,放出大量的热,促进溴化氢气体的挥发,所以实验中采用浓度较低的80%硫酸,
故答案为:防止溴化氢气体的挥发;
(5)乙醇在浓硫酸的作用下发生分子间脱水,生成乙醚,所以溴乙烷中含有副产物乙醚,乙醚和溴乙烷为互溶的有机物,可利用它们的沸点不同,进行蒸馏分离,
故答案为:乙醚;蒸馏;
本题解析:
本题难度:简单
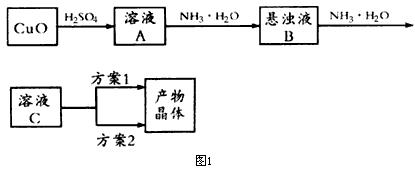
2、实验题 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下


请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图3所示,该装置中的错误之处是______________;抽滤完毕或中途停止抽滤时,应先__________,然后__________。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有______________杂质,产生该杂质的原因是
________________
(2)方案2的实验步骤为:a.向溶液C中加入适量________,b.___________,c.洗涤,d.干燥。
①请在上述内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是__________。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是________________
参考答案:(1)①布氏漏斗下口斜面应反转断开漏斗与安全瓶的连接;关闭水龙头;②CuSO4晶体;加热蒸发时促进了[Cu(NH3)4]2+电离产生Cu2+,Cu2+与[Cu(NH3)4]SO4·H2O电离产生的SO42-;在冷却结晶时析出CuSO4晶体杂质
(2)①(NH4)2SO4;过滤;②A;③加热干燥可能导致产物晶体失去结晶水
本题解析:
本题难度:一般
3、简答题 硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X?H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a?H2O?)对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80
溶解度/g/100g水
18.5
20.8
26.3
32.8
40.1
48.4
52.4
50.9
43.7
|
由于铁屑中含有C、Si等杂质,为了使FeSO4?溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止______.你认为实验时的水浴温度最好控制在______℃左右.从滤液中获得FeSO4?xH2O,下列操作中不需要的是______;
(A)冷却?(B)蒸发
(C)结晶?(D)洗涤?(E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
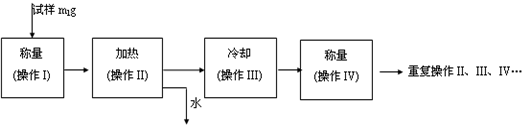
①其加热装置正确的是______
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______.
参考答案:(1)少量的铁锈和铁屑反应生成二价铁离子,所以对制取硫酸亚铁无影响,但必须是铁屑过量,保证溶液中三价铁离子完全转化为二价铁离子,
故答案为:无;生成的少量Fe3+?与铁屑反应转化为Fe2+;铁屑;
(2)根据图表分析知,0~60℃,温度越高硫酸亚铁的溶解性越大;60~80℃,温度越高溶解度反而减小;所以采取了水浴加热和趁热过滤的方法防止硫酸亚铁晶体析出;60℃时硫酸亚铁的溶解度最大,所以实验时的水浴温度最好控制在60℃左右;从滤液中获取硫酸亚铁晶体不需要蒸发,故选B.
故答案为:硫酸亚铁晶体析出;60℃;B;?
?(3)①测定FeSO4?xH2O中结晶水含量的实验中必须在坩埚中加热,装置应选C,故答案为:C;
②重复操作II、III、IV,直到连续两次称量结果相差不超过0.001g,故答案为:0.001;
③为防止空气中的物质和其反应,所以应在干燥器中冷却,故答案为:干燥器;?
(4)A、加热时,晶体溅出坩埚,应重新做实验,故A错误;
B、加热时,先用小火,后用大火加热,至恒重,故B错误;
C、加热时,不断用玻璃棒搅拌,防止局部受热造成液体飞溅,故C正确;
D、恒重操作是指两次称重之差不大于0.0003g,故D错误;
故答案为:C;
(5)灼烧时有黑色固体出现,说明硫酸亚铁分解生成气体,所以m(H2O)偏大;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气,则结晶水合物中m(H2O)偏小,
故答案为:偏大;偏小.
本题解析:
本题难度:一般
4、选择题 制取乙酸乙酯的装置正确的是(其中B和D的玻璃导管是插入到小试管内液面以下的)
[? ]
A.
B.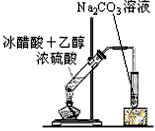
C.
D.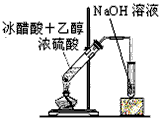
参考答案:A
本题解析:
本题难度:一般
5、实验题 摩尔盐[(NH4)2SO4·FeSO4·6H2O]是一种复盐,它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化。某实验小组查得硫酸铵、七水硫酸亚铁、硫酸亚铁铵的溶解度如下表
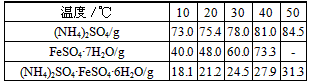
该实验小组在实验室按下列流程进行制取摩尔盐的实验:

(1)为了加快铁屑的溶解,可加入少量的________ (填物质名称)。
(2)反应I进行后要“趁热过滤”,其目的是:__________________。实验中要在反应Ⅱ的溶液中加入少量稀硫酸,其作用是:_________________。
(3)反应Ⅱ后的溶液经蒸发等操作所得固体用乙醇洗涤的目的是:___________________。
(4)在摩尔盐溶液中加入足量氨水,反应的离子方程式为:_______________
参考答案:(1)铜或硫酸铜等
(2)除去过量铁屑防止温度降低析出FeSO4·7H2O造成FeSO4的损失;抑制Fe2+、NH4+的水解
(3)除去固体表面的少量水分
(4)Fe2+ + 2NH3·H2O = Fe(OH)2↓+2NH4+
本题解析:
本题难度:一般