微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 把4mol?A和4mol?B混合放入容积为2L的密闭容器里,发生反应3A(g)+2B(g)═x?C(g)+2D(g),经5s后反应达平衡.在此5s内C的平均反应速率为0.1mol?L-1?s-1,同时生成2mol?D.试计算:
(1)达到平衡状态时B的转化率;
(2)试算x的值;
(3)若温度和压强维持不变,当生成2mol?D时,此时容器内气体的体积是多少?
参考答案:生成C的物质的量为0.1mol?L-1?s-1×5s×2L=1mol,
?(1)3A(g)+2B(g)═x?C(g)+2D(g),
起始(mol) 4?4? 0? 0
反应(mol)?3? 2?1? 2
平衡(mol)?1? 2?1? 2?
故平衡状态时B的转化率?2?4?×100%=50%;
(2)3A(g)+2B(g)═x?C(g)+2D(g),
起始(mol)? 4?4? ?0? 0
反应(mol) ?3? 2? ?1? 2
平衡(mol)?1? ?2? ? 1?2?
因反应的物质的量之比等于化学计量数之比,故x=1;
(3)反应前气体的总物质的量为8mol,体积为2L,反应后气体的总物质的量为1+2+1+2=6mol,因据温度和压强维持不变,物质的量和体积成正比,故容器内气体的体积是1.5L.
本题解析:
本题难度:一般
2、选择题 如图是表示:2X (g)+Y (g) ?Z (g)+R (g)?⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
?Z (g)+R (g)?⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是

A.减少Z物质
B.加大压强
C.升高温度
D.使用催化剂
参考答案:D
本题解析:由图可以看出,t1时改变条件,反应速率增大,而平衡不移动。减少Z物质,v减小,平衡右移,A错;加大压强,v增大,平衡右移,B错;升高温度,v增大,平衡左移,C错;使用催化剂,能同等程度的增大正逆反应速率,平衡不移动,选D。
点评:化学平衡图像是化学平衡的一个重要知识点,历年高考经常考查,考生在备考过程中应学会分析图像。
本题难度:一般
3、选择题 一定温度下,在容积为2L的密闭容器中发生反应C0(g)+H20(g) C02(g)+H2(g),部分数据见下表(表中t2>t1):
C02(g)+H2(g),部分数据见下表(表中t2>t1):
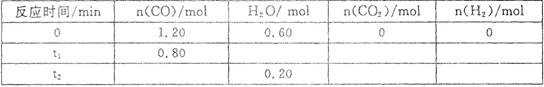
下列说法正确的是
A.反应在t1 min内的平均速率为
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)="0.60" mol, n(H20)=" 1.20" mol,则平衡时n(C02)=" 0." 20 mol
参考答案:C
本题解析:本题考查化学反应速率及化学平衡的有关计算。由反应方程式可知,氢气的平均反应速率等于CO的平衡反应速率,故有v(H2)=v(CO)=(1.2-0.8)/2t1,即,v(H2)=(0.2/t1)mol·L-1·min-1,故A不正确;根据表中数据可知,t2、t1时刻H2O的物质的量相等,说明在t1时刻已达平衡,则平衡时CO的转化率为0.4/1.2=33.3%,故B不正确;平衡常数为K=c(C02)×c(H2)/[c(C0)×c(H20)]=0.4×0.4/(0.8×0.2)=1,C正确;
C0(g)?+? H20(g)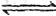 C02(g)+ H2(g)
C02(g)+ H2(g)
始量0.60?1.20? 0? 0
变量? x? x? x? x
平衡0.60-x? 1.20- x? x? x
则有x2/[(0.60-x)×(1.20- x)]=1,解得x=0.4,即n(C02)=" 0.40" mol,D不正确
本题难度:一般
4、选择题 下列图示与对应的叙述相符的是

A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
参考答案:A
本题解析:A、若T1>T2,温度升高A的转化率降低,说明升高温度平衡逆向移动,则正向是放热反应,△H<0,正确;B、图乙表示是否使用催化剂,因为到达平衡的时间改变而反应物的百分含量不变,说明平衡不移动,所以乙代表使用了催化剂,错误;C、调节溶液的pH=4,溶液呈酸性,若加入氢氧化钠溶液,则溶液呈碱性,铜离子也会沉淀,错误;D、用盐酸滴定氢氧化钠溶液,开始的pH是氢氧化钠溶液的pH值,应大于7,错误,答案选A。
本题难度:一般
5、填空题 (14分)金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。?

已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼?烧”所需主要仪器有?。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 ? 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O?未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为?(用小数表示,保留二位小数)。
参考答案:(14分)(1)FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O; (2分)
将Fe3+转化为Fe2+并防止Fe2+被氧化 (2分)
(2)b (1分)
(3)过滤 (1分)?坩埚(酒精灯、三脚架、泥三角不填不扣分,填错扣分,“坩埚”错别字不给分)(2分)
(4)溶液中存在平衡:TiO2+ + 3H2O 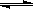 Ti(OH)4 + 2H+,当加入热水稀释、升温后,
Ti(OH)4 + 2H+,当加入热水稀释、升温后,
平衡正向移动,生成Ti(OH)4。 (2分)
(5)MnO2 + 2Fe2+ + 4H+ ="==" Mn2+ + 2Fe3+ + 2H2O?(2分)
(6)? 0.93(2分)
本题解析:(1)钛铁矿主要成分为钛酸亚铁(FeTiO3),酸溶后得TiO2+和Fe2+,所以步骤①化学反应方程式为:FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O;因为一部分铁元素在钛铁矿处理过程中会转化为+3价,所以加入铁粉目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,冷却、结晶将物质分离,是利用了物质的溶解性的不同,所以答案选b;
(3)步骤②、③、④中都是固、液分离,所以涉及到的操作是过滤;步骤⑤“灼烧”所需主要仪器有坩埚、酒精灯、三脚架、泥三角;
(4)步骤④溶液中存在平衡:TiO2+ + 3H2O 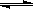 Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
(5)废液中含有未结晶的Fe2+,与二氧化锰发生氧化还原反应,生成Fe3+、Mn2+,离子方程式为MnO2 + 2Fe2+ + 4H+ ="==" Mn2+ + 2Fe3+ + 2H2O?;
(6)根据得失电子守恒规律,n(FeSO4·7H2O)=5n(KMnO4),250mL的溶液中n(FeSO4·7H2O)=19.00×10-3L×0.01mol/L×10×5=9.5×10-3mol,所以绿矾样品中FeSO4·7H2O的质量分数为9.5×10-3mol×278g/mol÷2.85g=0.93。
本题难度:一般