微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从溴水中萃取溴,下列试剂中能用做萃取剂的是
A.乙酸
B.水
C.四氯化碳
D.酒精
参考答案:C
本题解析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,选用的萃取剂的原则是:①和原溶液中的溶剂互不相溶更不能发生化学反应;②溶质在该溶剂中溶解度要远大于原溶剂。乙酸、乙醇和水是互溶的,不能作为从溴水中萃取溴的萃取剂。四氯化碳不溶于水,溴易溶在有机溶剂中,四氯化碳可以作为萃取剂,所以答案选C。
点评:该题是常识性知识的考查,侧重对学生实验能力的培养,有利于培养学生的逻辑思维能力和规范严谨的实验设计能力。该题的关键是明确萃取剂选择的依据,然后结合题意灵活运用即可。
本题难度:简单
2、填空题 有一包固体物质,可能含有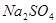 、
、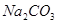 、
、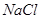 、
、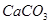 、
、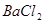 、
、 中的一种或几种,现做如下实验。请填空回答其中的问题:
中的一种或几种,现做如下实验。请填空回答其中的问题:
(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液;过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解。由此可知,原固体物质中一定含有?,可能含有?。
(2)为确定原固体物质中“可能含有”的物质是否存在,现取3.5g原固体,充分溶于水中,将得到的白色沉淀洗涤、烘干后称量,质量为2.33g。通过计算确定:“可能含有”的物质?(选填“一定存在”、“一定不存在”或“仍不能确定是否存在”)。
参考答案:(每空2分,共6分)(1)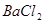 和
和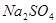 ?
?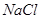 ?(2)一定不存在
?(2)一定不存在
本题解析:(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液,这说明一定没有硫酸铜。过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解,这说明白色沉淀应该是硫酸钡,而不是碳酸钙或碳酸钡,所以一定含有的是氯化钡和硫酸钠,而没有碳酸钙和碳酸钠,但氯化钠不能确定。
(2)2.33g是硫酸钡,物质的量是0.01mol,则硫酸钠和氯化钡的物质的量都是0.01mol,其质量之和是(142+208)×0.01=3.5g,这说明原固体混合物中一定没有氯化钠。
点评:该题是中等难度试题的考查,试题贴近高考,基础性强,在注重对学生基础知识检验和训练的同时,侧重对学生能力的培养。该题既有定性分析,也有定量计算,有利于培养学生的逻辑推理能力和创新思维能力,有利于提高学生的应试能力。
本题难度:一般
3、填空题 (1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:(1)B; CD
(2)4 ;3.3 ;可行
本题解析:
本题难度:一般
4、实验题 碘元素有“智力元素”之称。研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量。

(1)操作I为灼烧,则灼烧时用____盛装海带,操作II为____________________________;
(2)水浸时通常要将悬浊液煮沸2~3min,目的是______________________________;
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
[推测]:①以IO3ˉ形式存在;?②以Iˉ形式存在
[查阅资料]:IO3ˉ具有较强的氧化性,I2+2S2O32ˉ=2Iˉ+S4O62ˉ
将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸。
序号
| 实验方案
| 实验现象
| 结论
|
①
| 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II
| 无现象
| ?
|
②
| 往试管I中加入______
| 无现象
| 证明不是以IO3ˉ形式存在
|
③
| 往试管II中加入_______
| _______________
| 证明以 形式存在 形式存在
|
?
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将Iˉ氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为___________,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量_________________.(假设操作I、II过程中碘不损失,相对原子量I-127)
参考答案:(16分)(1)坩埚(2分);?过滤(2分)(共4分)
(2)加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液。(2分)
(3)②FeCl2溶液,后加入2滴KSCN溶液并振荡;③3%H2O2溶液并振荡;溶液变蓝(每空2分共6分)
(4)溶液蓝色刚好褪去,30s内不恢复蓝色; (每空2分,共4分)
(每空2分,共4分)
本题解析:(1)干海带是固体可燃物,灼烧时应选坩埚盛装少量干海带;过滤可以将浊液分离固体和溶液,则操作II是过滤;(2)含碘物质的溶解度随温度升高而增大,则将海带灰的悬浊液煮沸的目的是加快含碘物质的溶解,提高固体粉末I中碘元素的浸出率;(3)实验②:若溶液A中含有IO3ˉ,因其具有较强的氧化性,能将亚铁离子氧化为铁离子,铁离子遇KSCN溶液变红,若不存在IO3ˉ,则试管I中加入FeCl2溶液、KSCN溶液,振荡后无现象;实验③:若存在Iˉ,因其具有还原性,能被双氧水氧化为单质碘,淀粉遇碘变蓝,则试管II中加入3%H2O2溶液,振荡,若溶液变蓝,证明存在Iˉ;(4)滴定前,溶液B中含有单质碘,淀粉溶液遇碘变蓝;滴定时,I2+2S2O32ˉ=2Iˉ+S4O62ˉ;滴定终点时,溶液中无单质碘,只有碘离子,淀粉遇碘离子不变蓝,所以重点现象为溶液蓝色恰好褪去,且半分钟内不恢复为蓝色;由于n=c?V,则三次滴定平均消耗V×10ˉ5mol S2O32ˉ,根据离子方程式中系数之比等于物质的量之比,则溶液B中含有V×10ˉ5/2mol I2;根据碘元素守恒可得关系式:2Iˉ~I2,由此推断20mL溶液A中含有V×10ˉ5mol Iˉ,则200mL溶液中含有的Iˉ为V×10ˉ4mol,则m(I)="127" V×10ˉ4g;根据碘元素的质量守恒,则海带中含有127 V×10ˉ4g碘元素,海带中碘元素的百分含量="127" V×10ˉ4/a×100%=1.27V/a%。
本题难度:一般
5、选择题 下列除杂所用试剂和操作均合理的是
[? ]
物质(括号中为杂质)?
除杂试剂
操作
A.
铁屑(汽油)?
热纯碱溶液
洗涤
B.
BaCO3 ( BaSO4)?
饱和Na2CO3溶液
搅拌、过滤
C.
乙酸乙酯(乙酸)?
NaOH溶液
蒸馏
D.
氯化氢(Cl2)?
饱和食盐水
洗气
参考答案:B
本题解析:
本题难度:一般