微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从溴水中萃取溴,下列试剂中能用做萃取剂的是
A.乙酸
B.水
C.四氯化碳
D.酒精
2、填空题 有一包固体物质,可能含有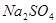 、
、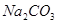 、
、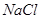 、
、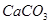 、
、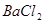 、
、 中的一种或几种,现做如下实验。请填空回答其中的问题:
中的一种或几种,现做如下实验。请填空回答其中的问题:
(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液;过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解。由此可知,原固体物质中一定含有?,可能含有?。
(2)为确定原固体物质中“可能含有”的物质是否存在,现取3.5g原固体,充分溶于水中,将得到的白色沉淀洗涤、烘干后称量,质量为2.33g。通过计算确定:“可能含有”的物质?(选填“一定存在”、“一定不存在”或“仍不能确定是否存在”)。
3、填空题 (1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
4、实验题 碘元素有“智力元素”之称。研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量。

(1)操作I为灼烧,则灼烧时用____盛装海带,操作II为____________________________;
(2)水浸时通常要将悬浊液煮沸2~3min,目的是______________________________;
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
[推测]:①以IO3ˉ形式存在;?②以Iˉ形式存在
[查阅资料]:IO3ˉ具有较强的氧化性,I2+2S2O32ˉ=2Iˉ+S4O62ˉ
将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸。
序号
| 实验方案
| 实验现象
| 结论
|
①
| 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II
| 无现象
| ?
|
②
| 往试管I中加入______
| 无现象
| 证明不是以IO3ˉ形式存在
|
③
| 往试管II中加入_______
| _______________
| 证明以 形式存在 形式存在
|
?
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将Iˉ氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为___________,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量_________________.(假设操作I、II过程中碘不损失,相对原子量I-127)
5、选择题 下列除杂所用试剂和操作均合理的是
[? ]
物质(括号中为杂质)?
除杂试剂
操作
A.
铁屑(汽油)?
热纯碱溶液
洗涤
B.
BaCO3 ( BaSO4)?
饱和Na2CO3溶液
搅拌、过滤
C.
乙酸乙酯(乙酸)?
NaOH溶液
蒸馏
D.
氯化氢(Cl2)?
饱和食盐水
洗气