微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b ;
②若所得混合液的pH=2,则a∶b ;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值__ _7,混和前c(NH3·H2O)_ _ c(HCl),氨水中c(OH-) _盐酸中c(H+)。(填>、<或=,下同)
参考答案:(1)10∶1 (2分) 9∶2 (2分)
(2)=" " > <(每空2分)
本题解析:略
本题难度:一般
2、填空题 (16分)
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
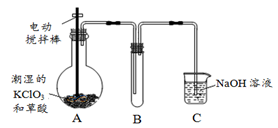
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据下图所示的NaClO2的溶解度曲线,

请补充从NaClO2溶液中制得NaClO2的操作步骤:① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2= Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是 。
②原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
参考答案:(16分)
(1)2KClO3 + H2C2O4 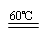 K2CO3 + CO2↑+ 2ClO2↑+ H2O(3分)
K2CO3 + CO2↑+ 2ClO2↑+ H2O(3分)
(2)温度计(2分) 冰水浴(2分)
(3)①蒸发浓缩结晶(2分) ②趁热过滤(2分)
(4)①减少实验误差(2分) ②135cV2/ V1(3分)
本题解析:(1)根据题意,氯酸钾与草酸在60℃时反应生成碳酸钾、二氧化碳、二氧化氯、水,化学方程式为2KClO3 + H2C2O4 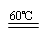 K2CO3 + CO2↑+ 2ClO2↑+ H2O;
K2CO3 + CO2↑+ 2ClO2↑+ H2O;
(2)A必须添加温度控制装置,所以A中应添加的玻璃仪器是温度计;因为制取ClO2的熔沸点较低,所以应在较低温度下收集,所以B应选择冰水浴;
(3)从溶液中得到晶体需要蒸发浓缩溶液,再过滤,因为温度高于38℃时析出晶体是NaClO2,温度太高,溶解度增大,所以应趁热过滤,再洗涤、干燥;
(4)①滴定过程中,至少须进行两次平行测定的原因是可以减少实验误差;
②ClO2被还原为氯离子,I-被氧化为碘单质,根据得失电子守恒,则2ClO2~5I2,再根据Na2S2O3与碘单质的关系,则2ClO2~5I2~10 Na2S2O3,所以消耗Na2S2O3溶液V2 mL时,V2mLClO2溶液中ClO2的物质的量是c mol·L—1×V2×10-3L/5,则质量是c mol·L—1×V2×10-3L/5×67.5g/mol=67.5cV2×10-3/5g,则原溶液中ClO2浓度为67.5cV2×10-3/5g×10/(V1×10-3L)=135cV2/V1g/L。
考点:考查物质的制备,实验方案的设计,基本操作的判断,实验结果的计算
本题难度:困难
3、选择题 下列各物质投入水中,因促进水的电离而使溶液呈酸性的是
A.HCl
B.NaHSO4
C.Na2SO4
D.NH4Cl
