微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (4分)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,则:
①总电池反应的离子方程式为?。
②有?mol电子通过了电线?
③此时溶液中H+的物质的量浓度为?(不考虑溶液体积变化)。
参考答案:①Fe+2H+ = Fe2+ + H2↑②0.3?③1.5mol/L
本题解析:略
本题难度:简单
2、选择题 下列有关电池的叙述不正确的是( )
A.水果电池是方便实用的家用电池
B.铅蓄电池是一种常用的二次电池
C.氢氧燃料电池是一种高效、无污染的发电装置
D.锌锰干电池工作一段时间后,锌外壳逐渐变薄
参考答案:A、水果电池对环境无污染,所以是环保电池,但水果价格较贵,且水果的利用率不高,所以水果电池不是高效的家用电池,故A错误;
B.铅蓄电池能重复利用,是常用的二次电池,故B正确;
C.氢氧燃料电池的产物是水,对环境无污染,且原料利用率较高,故C正确;
D.锌锰干电池负极上金属锌失电子而使金属质量逐渐减小,故D正确;
故选A.
本题解析:
本题难度:简单
3、实验题 (1)可以验证镁、铝的金属性强弱的实验是_____________。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
参考答案:(1)bc
(2)分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入适量NaOH溶液或氨水,将所得沉淀分别等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,Mg(OH)2不溶解,
Al(OH)3溶解;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。
本题解析:
本题难度:一般
4、填空题 按下列要求自制铜-镁简易电池,并回答有关问题。
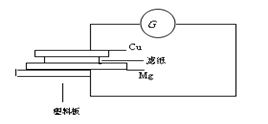
a.用砂纸擦净一块铜片和镁条。
b.用盐酸溶液浸湿一张滤纸,把浸湿的滤纸放在镁条上。
c.把滤纸和镁条并放在一块塑料板上。
d.把镁条连接到电流计的一个端钮
e.把铜片压在滤纸上。
f.把铜片连接到电流计的另一个端钮。
g.观察电流表指针变化。
请回答下列问题。
(1)在以上简易电池中, 是负极,电极反应式
是正极,电极反应式
(2)在以上电池中,电子由 经 流向
参考答案:(1) Mg Mg - 2e- = Mg2+ Cu 2H+ + 2e_ = H2↑
(2)负极(或镁极板),导线或外电路或电流计,正极(或铜极板)
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。镁的金属性强于铜,则镁是负极,失去电子,电极反应式是Mg - 2e- = Mg2+;铜是正极,溶液中的氢离子得到电子,电极反应式是2H+ + 2e_ = H2↑。
(2)该原电池中,电子由负极(或镁极板)经导线或外电路或电流计流向正极(或铜极板)。
考点:考查原电池应用的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
5、填空题 某市中学化学兴趣小组利用下图所示原电池装置进行实验,请回答下列问题:

(1)实验中,同学们发现两装置电流计的指针偏转方向不同,因此有人提出以下观点,其中正确的是____________。(双选题,漏选得2分,多选错选得0分)
A.金属活动性铝比镁强
B.金属活动性镁比铝强,两装置中镁均为负极
C.仅根据金属活动性顺序不能准确判断原电池的正负极
D.原电池中的正负极受电解质溶液的酸碱性、强氧化性等因素的影响