微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
|
N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,Q 0
(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
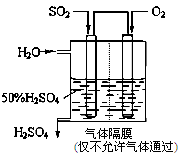
(2)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极发生 (填“氧化”或“还原”)反应,电极反应式为 。
参考答案:(13分)
(1)①0.032mol·L-1·min-1(2分,无单位或单位错误扣1分),0.25 (2分)
②ad(2分,选对一个给1分,错选不给分);
③<(2分); ④bc(2分,选对一个给1分,错选不给分);
(2)氧化 (1分) SO2 + 2H2O-2e-===SO42-+4 H+ (2分)
本题解析:(1)①0~10min内,NO的平均反应速率v(NO)=(1.00-0.68)mol/L/10min=0.032mol·L-1·min-1 ;反应进行到20min时反应达到平衡状态,各物质的平衡浓度表中已知,所以T1℃时,该反应的平衡常数K=0.25×0.25/0.502=0.25;
②30min后,只改变某一条件,反应重新达到平衡,各物质的浓度比原平衡都增大了。a、通入一定量的NO,平衡正向移动,再达平衡时,各物质的浓度均增大,正确;b、活性炭是固体,对平衡无影响,错误;c、加入合适的催化剂,只改变反应速率,不改变平衡,浓度不变,错误;D、缩小容器的体积,压强增大,但平衡不移动,各物质的浓度均增大,正确,答案选ac;
③现在的平衡体系中NO、N2、CO2的浓度之比为2:1:1,升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,说明NO的浓度增大,升高温度,平衡逆向移动,所以正向是放热反应,Q<0;
④a、单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g),都表示逆反应速率,不能判断平衡的到达,错误;b、该反应有固体参加,所以气体的质量一直改变,而气体的物质的量一直不变,额气体的平均相对分子质量一直在变,所以达到平衡时混合气体的平均相对分子质量不再改变,正确;c、容器的体积不变,而气体的质量变化,所以混合气体的密度发生变化,达到平衡时混合气体的密度不再发生改变,正确;d、该反应是气体的物质的量不变的可逆反应,所以压强一直不变,不能判断平衡的达到,错误,答案选bc;
(2)该装置是原电池装置,用二氧化硫生成硫酸,则二氧化硫中S的化合价升高,发生氧化反应;电解质溶液为稀硫酸,则二氧化硫发生 氧化反应的电极反应式为SO2 + 2H2O-2e-===SO42-+4 H+ 。
考点:考查化学平衡理论的应用,原电池的反应原理的应用
本题难度:一般
2、选择题 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有

A.3种
B.4种
C.5种
D.6种
参考答案:D
本题解析:
电解质是稀H2SO4时,电极可选的组合为:Cu Fe;Cu Zn;Fe Zn三种。
电解质是Fe2(SO4)3溶液时,电极可选的组合为:Cu Fe;Cu Zn;Fe Zn三种。
故选D,共6种
本题难度:简单
3、选择题 有如表所示三个实验
实验1
| 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易被腐蚀
|
实验2
| 将片状的金属X、W分别投入等体积、等物质的量浓度的盐酸中,都有气体产生,W比X反应剧烈
|
实验3
| 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z
|
依据上述实验现象,下列推测正确的是( )?
A.金属的活动性顺序:Y>Z>X>W
B.实验1中,Y作正极
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,X作正极
参考答案:B
本题解析:A、实验1表明X的活泼性大于Y,Y为原电池的正极;实验2表明W比X活泼;实验3表明Y比Z活泼,据此可知金属的活动性顺序:W>X>Y>Z,错误;B正确;C、如果Z位于金属活动性顺序表中Cu以后,则Z不能置换出Cu,错误;D、用X、Z和稀硫酸构成原电池时,X活泼为负极,错误,答案选B。
本题难度:一般
4、选择题 下列装置或操作能达到实验目的是( )
A.

构成铜锌原电池
B.
二氧化碳制取装置
C.
利用排空气法收集H2
D.

实验室制取并收集氨气
参考答案:C
本题解析:
本题难度:简单
5、填空题 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题:
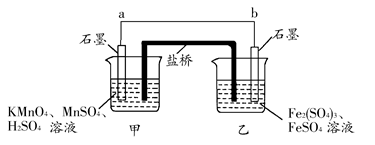
(1)发生氧化反应的烧杯是________(填“甲”或“乙”)。
(2)外电路的电流方向为:从________到________。(填“a”或“b”)
(3)电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。
(4)甲烧杯中发生的电极反应为______________________________。
参考答案:(1)乙 (2)a b (3)乙
(4)MnO4—+8H++5e-=Mn2++4H2O
本题解析:根据氧化还原反应可知:甲烧杯中石墨作正极,发生还原反应,电极反应为:MnO4—+8H++5e-=Mn2++4H2O;乙烧杯中石墨作负极,发生氧化反应,电极反应为Fe2+-e-=Fe3+,外电路电流方向从正极流向负极,即从a到b。电池工作时,盐桥中的阴离子移向负极,阳离子移向正极,即SO42—移向乙烧杯。
本题难度:一般