微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:?

(1)?f?元素在周期表中的位置是第____周期第____族。
(2)?e?与f?两元素最高价氧化物的水化物相互反应的化学方程式为____________________。
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4)?化合物ca3?的电子式为_________?,c和d两种元素氢化物的稳定性更强的是?_______(填物质的化学式)。
参考答案:(1)?3;IIIA?
(2)NaOH+Al(OH)3=NaAlO2+2H2O?
(3)?离子键;共价键?
(4)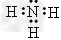 ;H2O
;H2O
本题解析:
本题难度:一般
2、选择题 下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
A.常温时,A能从酸中置换出氢,而B不能
B.B的最高价氧化物对应水化物的碱性比A的强
C.1molA从酸中置换生成的H2比1molB从酸中置换生成的H2多
D.A原子最外层电子数比B原子的最外层电子数少
参考答案:解;A.常温时,A能从酸中置换出氢,而B不能,可说明A比B活泼,故A正确;
B.B的最高价氧化物对应水化物的碱性比A的强,可说明B的活泼性比A强,故B错误;
C.比较金属性强弱,可与酸反应的剧烈程度,不能根据生成氢气的多少,故C错误;
D.比较金属性的强弱,应根据失去电子的难易程度,不能根据核外电子的多少,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称来自按构造原理最后填入电子的能级符号。
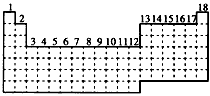
(1)请在上表中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影 表示d区和ds区。
表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内第6、7纵行的部分元素可以排在另一区,你认为应排在
____________区。
(3)请在元素周期表中用元素符号标出4s轨道半充满状态的元素。
参考答案:(1)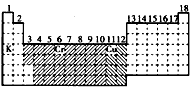 (2)ds
(2)ds
(3)见上表
本题解析:
本题难度:一般
4、选择题 下图所示是短周期的一部分,已知B原子与C原子核外电子总数之和为A的4倍,则下列推断中正确的是
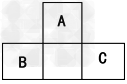
[? ]
A.A、B、C三者均为非金属元素
B.A、B、C三者核电荷数之和为40
C.A与B、A与C均可形成离子化合物
D.B与C只能形成一种共价化合物
参考答案:AB
本题解析:
本题难度:一般
5、选择题 下列各种关系的比较,均正确的是( )
A.熔沸点:Li>Na>K>Bb;SiO2>NaCl>Na
B.酸性:H3PO4>H3AsO4;HClO>H2CO3
C.微粒半径:K+>Na+>Mg2+>Ba2+
D.热稳定性:H2O>NH3>PH3>SiH4;SnH4>GeH4>SiH4>CH4
参考答案:A.熔沸点一般为原子晶体>离子晶体>金属晶体,碱金属的熔沸点随原子序数的增大而减小,所以熔沸点为Li>Na>K>Bb,SiO2>NaCl>Na,故A正确;
B.非金属性P>As,所以酸性为H3PO4>H3AsO4,由强酸制弱酸的反应可知,酸性为HClO<H2CO3,故B错误;
C.电子层越多,离子半径越大,有相同电子排布的离子,原子序数大的离子半径小,
则微粒半径为Ba2+>K+>Na+>Mg2+,故C错误;
D.非金属性越强,气态氢化物越稳定,所以热稳定性为H2O>NH3>PH3>SiH4,SnH4<GeH4<SiH4<CH4,故D错误;
故选A.
本题解析:
本题难度:一般