微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
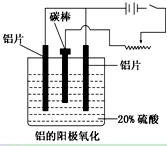
2Al2O3? ?4Al+3O2↑
?4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材?B.石墨? C.铅板?D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
参考答案:(1)主要是降低Al2O3的熔化温度
(2)Al-3e-=Al3+? D
(3)2Al-6e-+3H2O=Al2O3+6H+
(4)铝阳极表面不断生成氧化物,电阻增大,为了保持稳定的电流,需要不断增大电压
(5)BD
本题解析:(1)由于Al2O3熔点很高,加入冰晶石可以降低Al2O3的熔点,作助熔剂。
(2)在电解池中阳极发生氧化反应,金属失去电子,电极反应式为Al-3e-=Al3+;电解精炼铝应以纯铝作阴极材料,故D项正确。
(3)根据阳极发生氧化反应可以得到电极反应式为:2Al+3H2O-6e-=Al2O3+6H+。
(4)铝阳极生成氧化物薄膜后会使电阻增大,为了保持稳定的电流,需要随电阻增大而不断增大电压。
(5)阳极氧化应用的是电解原理,A项错误;由于氧化物的生成可以增强铝表面的绝缘性,B项正确;铝的阳极氧化可以提高铝及铝合金的耐腐蚀性,但耐磨性不下降,C项错误;氧化铝具有不同的晶型,其中的δ-Al2O3具有多孔性、强吸附性和催化活性,可做吸附剂和催化剂,D项正确。
本题难度:一般
2、简答题 实验室常用二氧化锰和浓盐酸共热的方法制取氯气,根据要求回答下列问题.
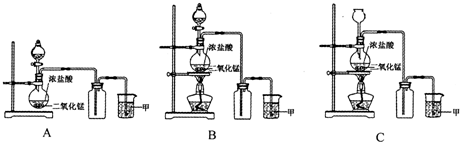
(1)A、B、C三套装置中,应选用的装置是______(选填“A”、“B”、“C”);
(2)为了防止氯气污染环境,图中所示的溶液甲为______.
(3)要制得纯净干燥的氯气,需要在气体发生装置和收集装置间增加净化装置,请将下面提供仪器的导管接口按次序连接:
气体发生装置→______→______→______→______→收集装置.(用字母表示)
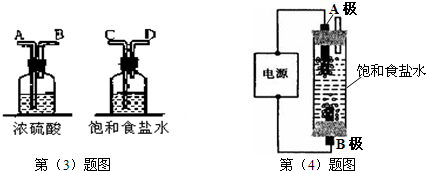
(4)工业上用电解饱和食盐水的方法制备氯气,写出其化学反应原理,并用“双线桥法”标出电子转移的方向和数目______.有人用上图所示装置制取消毒液(主要成分为NaClO),则A极应该接电源的______极(填正、负).
参考答案:(1)实验室用二氧化锰和浓盐酸共热的方法制取氯气,A缺少加热装置,HCl易挥发,不能用长颈漏斗,应用分液漏斗,只有B符合,故答案为:B;
(2)氯气有毒,不能排放到空气中,氯气与碱反应,可用NaOH溶液吸收,故答案为:NaOH溶液;
(3)要制得纯净干燥的氯气,应先将混合气体通过盛有饱和NaCl溶液的洗气瓶,除去HCl气体,再通过浓硫酸干燥,气体通过洗气瓶时,气体要长进短出,所以,连接顺序为,发生装置→C→D→A→B→收集装置,
故答案为:发生装置→C→D→A→B→收集装置;
(4)反应在通电条件下生成氢气和氯气,反应中,Cl元素的化合价有-1价升高到0价,每生成1个氯气分子失去2个电子,H元素的化合价由+1价降低到0价,每生成1个氢气分子得到2个电子,用图中装置制备消毒液,氯气应在B极上生成,才能充分与A极生成的NaOH充分反应生成NaClO,所以A极为阴极,连接电源的负极,
故答案为:
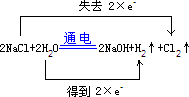
;负.
本题解析:
本题难度:一般
3、填空题 海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分
| Na+
| K+
| Ca2+
| Mg2+
| Cl-
| S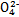
| HC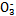
|
含量/(mg·L-1)
| 9 360
| 83
| 200
| 1 100
| 16 000
| 1 200
| 118
|
?
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。?
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
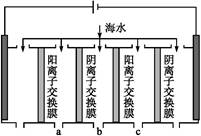
电渗析原理示意图
①阴极的电极反应为 。?
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。?
③淡水的出口为a、b、c中的 出口。?
参考答案:(1)HC +H2O
+H2O H2CO3+OH- 5×10-3
H2CO3+OH- 5×10-3
(2)①2H2O+2e- H2↑+2OH-(或2H++2e-
H2↑+2OH-(或2H++2e- H2↑)
H2↑)
②Ca2++OH-+HC
 CaCO3↓+H2O ③b
CaCO3↓+H2O ③b
本题解析:(1)c(Ca2+)= ;(2)阳离子向右边阴极移动、阴离子向左边阳极移动,可知b中为淡水
;(2)阳离子向右边阴极移动、阴离子向左边阳极移动,可知b中为淡水
本题难度:一般
4、填空题 (14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3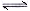 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
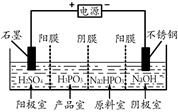
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
参考答案:(1)①H3PO3+OH—=H2PO3—+H2O (2分) ②> (2分)
③c(H+)> c(H2PO3-)> c(HPO32-) (2分)8.3×10-3mol/L(2分)
(2)H3PO3+ I2+H2O = 2HI+ H3PO4 (2分) (3)①2H++ 2e-=H2↑ (2分)
②HPO32-+ 2H+=H3PO3(2分)[(或:HPO32-+ H+=H2PO3-、H2PO3-+ H+=H3PO3(各1分)]
本题解析:(1)①亚磷酸是二元弱酸,与少量NaOH溶液反应生成酸式盐,反应的离子方程式为H3PO3+OH—=H2PO3—+H2O。
②亚磷酸是二元弱酸,因此相应的正盐Na2HPO3在溶液中水解溶液显碱性,则pH>7。
③亚磷酸是二元弱酸,以第一步电离为主,又因为水中还存在电离平衡,所以除OH—之外其他离子的浓度由大到小的顺序是c(H+)> c(H2PO3-)> c(HPO32-);根据H3PO3溶液存在电离平衡H3PO3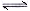 H++ H2PO3-可知,溶液中c(H2PO3-)≈c(H+)=2.5×10-2mol·L-1,c(H3PO3)=0.1000 mol·L-1-2.5×10-2mol·L-1=0.075mol/L,所以该温度下电离常数K=
H++ H2PO3-可知,溶液中c(H2PO3-)≈c(H+)=2.5×10-2mol·L-1,c(H3PO3)=0.1000 mol·L-1-2.5×10-2mol·L-1=0.075mol/L,所以该温度下电离常数K=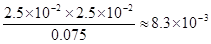 。
。
(2)亚磷酸具有强还原性,可使碘水褪色,在反应中被氧化为磷酸,反应的化学方程式为H3PO3+ I2+H2O = 2HI+ H3PO4。
(3)①电解池中阴极得到电子,因此阴极是溶液中的氢离子放电,电极反应式为2H++ 2e-=H2↑。
②阳极氢氧根离子放电,同时产生氢离子,氢离子进入产品室与Na2HPO3反应得到亚磷酸,所以在产品室生成亚磷酸的方程式为HPO32-+ 2H+=H3PO3。
考点:考查弱电解质的电离、离子浓度大小比较、氧化还原反应以及电化学原理的应用
本题难度:困难
5、选择题 用质量均为100 g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28 g,此时两电极的质量分别为
A.阳极100 g,阴极128 g
B.阳极91.0 g,阴极119.0 g
C.阳极93.6 g,阴极121.6 g
D.阳极86.0 g,阴极114.0 g