微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程

请回答:
(1) MgCl2·6H2O溶于水,溶液呈____(填“酸性”、“中性”或“碱性”)。
(2)蒸氨是将石灰乳通入氯化铵溶液中,并加热,写出该反应的化学方程式:________________。
(3)轻烧后的产物为__________。
(4)检验沉淀已洗涤干净的方法是____________________。
(5)氨化反应过程中反应的离子方程式为_____________________。
(6)已知向Mg(OH)2沉淀中边滴加氯化铵溶液边振荡可观察到沉淀溶解,试解释该反应发生的原理:_____________________ (用离子方程式表示和文字说明)。
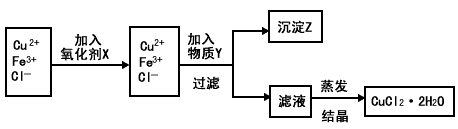
2、填空题 制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2
II.对I中所得到的溶液按下列步骤进行提纯?

试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是____________ 。(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是_____________
②写出沉淀Z在水中的沉淀溶解平衡方程式:_______________
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是__________ 。
(4)①某同学利用反应:Cu+2H+===Cu2+ +H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 _____________。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。

(5)已知一些难溶物的浓度积常数如下表:某工业废水中含有Cu2+ 、Pb2+ 、Hg2+ ,最适宜向此工业废水中加入过量的___________除去它们。(选填序号)
①NaOH ②FeS ③Na2S
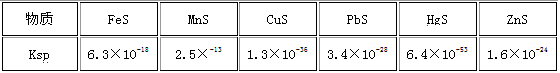
3、填空题 活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下
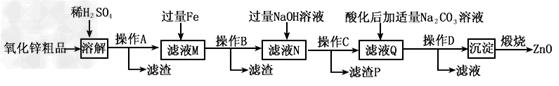
已知:Zn(OH)2可溶于NaOH溶液。 ?
(1)操作A所用的玻璃仪器有烧杯、玻璃棒和______________。 ?
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是__________________________。?
(3)加入过量铁可回收的金属是_______________。
(4)操作C所得的滤渣P中Fe(OH)2和Fe(OH)3的物质的量之比为5:1,该滤渣在空气中灼烧可获得高性能的磁粉Fe3O4,写出该反应的化学方程式______________________。
(5)“沉淀”的成分为ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为__________________________。 ?
(6)取20.00mL。滤渡N,用0.02mol/L的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为__________________mol/L。
4、填空题 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是__________,_________反射炉内生成炉渣的主要成分是____;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是____;
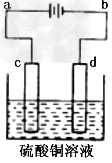
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极____(填图中的字母);在电极d上发生的电极反应式为______;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____。
5、填空题 某炼铁废渣中含有大量CuS及少量的铁和铁的化合物,工业上以该废渣为原料生产CuCl2·2H2O的流程如下
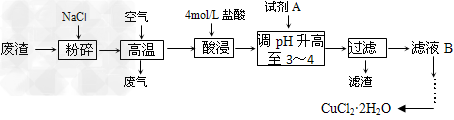
请回答下列问题:
(1)废渣中的铁在潮湿的空气中发生吸氧腐蚀,其正极反应式为___________________。
(2)高温煅烧时CuS发生的反应为:___CuS?+?__NaCl?+?__O2→?___CuCl2?+?____Na2SO4,配平该反应方程式。
(3)调pH后铁元素生成滤渣的离子方程式为______________?。
(4)试剂A最好选用下列三种物质中的________(填序号):
a.NaClO?b.Cl2?c.浓硫酸
理由是__________________。
(5)分析下图溶解度曲线回答:
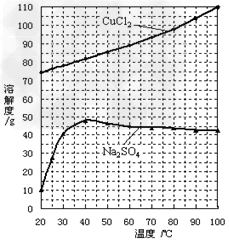
①为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:蒸发浓缩、_________、滤液冷却结晶、过滤得到产品。
②“冷却结晶”过程中,析出CuCl2·2H2O晶体的合适温度或温度范围是____________。