微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁和镍的化合物。
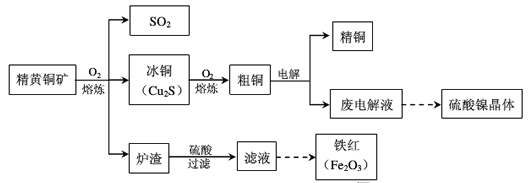
回答下列问题。
(1) Cu2S熔炼过程发生的主要反应为:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2 kJ/mol
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ/mol
在熔炼过程中不需要持续加热,原因是____。
(2)熔炼过程中产生大量的___(填分子式),可进一步加工并作为上述流程中的原料加以循环利用。
(3)炉渣的主要成分是Fe2O3、FeO、Al2O3、SiO2,为了得到铁红,需对上述滤液进行处理,处理过程涉及下列步骤中的___(填序号)。
A.氧化 B.还原 C.灼烧 D.加碱
(4)废电解液中含有较多的Ni2+ ,从废电解液提取硫酸镍晶体,需要用电解法把电解液中的Cu2+ 除去,电解的阳极可以采用___作为电极材料,阳极的电极反应式是____。
(5)从废电解液中除去Pb2+的方法是往其中通入H2S至饱和,使Pb2+转化为硫化铅沉淀,溶液的 pH对转化效果的影响是____。已知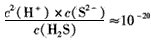 ,饱和H2S溶液中c( H2S)为0.1 mol/L,NiS的Ksp=10-11,若废 电解液的pH =5,为保证不生成NiS沉淀,Ni2+的浓度应控制在__以下。
,饱和H2S溶液中c( H2S)为0.1 mol/L,NiS的Ksp=10-11,若废 电解液的pH =5,为保证不生成NiS沉淀,Ni2+的浓度应控制在__以下。
参考答案:(1)Cu2S与O2反应的热化学方程式为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H= - 217.4kJ/mol,反应放出的热量足以维持反应的进行
(2) SO2
(3)ACD
(4)惰性电极 ;4OH--4e-=2H2O+O2↑(或Ni - 2e - =Ni2+)
(5)溶液的pH越大,转化效果越好 ;1 mol/L
本题解析:
本题难度:困难
2、填空题 以水氯镁石(主要成分为 )为原料生产碱式碳酸镁的主要流程如下
)为原料生产碱式碳酸镁的主要流程如下

(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的 ,若溶液中
,若溶液中
 ,则溶液中
,则溶液中 =_______________。
=_______________。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为__________________。
(3)高温煅烧碱式碳酸镁得到 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下 0.896L,通过计算确定碱式碳酸镁的化学式。__________________________
0.896L,通过计算确定碱式碳酸镁的化学式。__________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有 ,则产品中镁的质量分数_____________(填 “升高”、“降低”或“不变”)。
,则产品中镁的质量分数_____________(填 “升高”、“降低”或“不变”)。
参考答案:(1)2.0 mol·L
(2)NH4Cl (3)



碱式碳酸镁的化学式为: (4)升高
(4)升高
本题解析:
本题难度:困难
3、填空题 β-锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含 有FeO、CaO、MgO等。以β-锂辉石为原料制备碳酸锂的一种流程如下:?
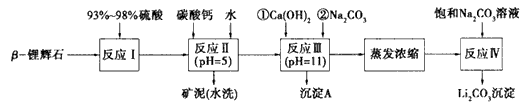
已知:
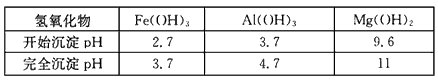
①部分金属氢氧化物开始沉淀和完全沉淀的pH:
②Li2CO3在不同温度的溶解度如下表:
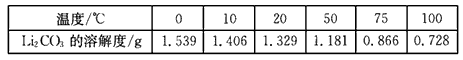
回答下列问题:
(1)反应Ⅱ中加碳酸钙的作用是____。
(2)写出反应Ⅲ中生成沉淀A的离子方程式___、____。
(3)写出反应Ⅳ的化学方程式___。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是____。
参考答案:(1)除去反应I中过量的H2SO4,控制pH使Fe3+ 、 Al3+完全沉淀
(2)Mg2+ +2OH-=Mg(OH)2↓? ;Ca2++CO32- = CaCO3↓
(3) Li2SO4+Na2CO3=Li2CO3↓+Na2SO4? ;Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
本题解析:
本题难度:一般
4、填空题 无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如下图所示。铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表)。


(1)试剂X可以用下列试剂中的__________(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是_________________;
(3)除铁时,必须先加入高锰酸钾溶液,目的是_____________________;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式____________________;
(4)滤渣的含铁成分是__________;
(5)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用______________________。
参考答案:(1)a
(2)pH超过3.3将导致Al3+沉淀,降低成品产量(意思合理即可)
(3)把Fe2+转化为Fe3+;2KMnO4+3MnSO4+2H2O==5MnO2↓+2H2SO4+K2SO4
(4)Fe(OH)3
(6)吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动)
本题解析:
本题难度:一般
5、填空题 钡盐生产中会排出大量的钡泥[主要含有 等]。某化工厂主要生产
等]。某化工厂主要生产
 ,现利用钡泥制取
,现利用钡泥制取 ,其部分工艺流程如下
,其部分工艺流程如下

(1)酸溶后溶液中 ,
, 的反应化学方程式为_________________。
的反应化学方程式为_________________。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,其原因是___________、___________。
(3)该厂结合本厂生产实际选用的X为________(填化学式);“中和Ⅰ”会使溶液中________(填离子符号)的浓度减少(“中和Ⅰ”引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是_____________________。
参考答案:(1)Ba(FeO2)2 +8HNO3 == Ba(NO3)2 + 2Fe(NO3)3 + 4H2O
(2)防止反应速率过快;浓硝酸易挥发和分解
(3)BaCO3;Fe3+、H+
(4)减少废渣中可溶性钡盐对环境的污染
本题解析:
本题难度:一般