微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,搅拌后静置,最终所得晶体的质量是
A.于1.06g
B.介于1.06和2.86g之间
C.等于2.86g
D.大于2.86g
参考答案:D
本题解析:估算法
饱和Na2CO3溶液中加入无水Na2CO3的反应如下:
Na2CO3+10H2O=Na2CO3·10H2O
106?286
1.06g? =">?" 2.86g
由于水以结晶水的形式减少,又导致一部分晶体析出,最后得到的晶体质量大于2.86g。
本题难度:一般
2、填空题 (10分)某纯碱样品中只含有NaHCO3杂质,兴趣小组为了测定该样品中Na2CO3的纯度,设计了以下几种实验方案:
方案I:取一定量的样品配成溶液,滴加2滴酚酞,用c mol/LHCL溶液滴定至无色,用去HCl溶液的体积为V1mL;再滴加2滴甲基橙,继续用c mol/LHCl溶液滴定至橙色,又用去HCl溶液的体积为V2mL。用c、V1、V2计算出Na2CO3的纯度。
方案Ⅱ:称取m1 g样品溶于水,滴加过量BaCl2溶液,过滤,将所得BaCO3沉淀经洗涤、干燥后称得其质量为m2 g,用m l、m2计算出Na2CO3的纯度。
方案Ⅲ:称取m3g样品与足量稀H2SO4溶液反应,用排饱和碳酸氢钠溶液的方法测得生成的CO2的体积为V3 L(已折换成标准状况),用m3、V3计算出Na2CO3的纯度。
方案Ⅳ:称取m4g样品与足量稀H2SO4溶液反应,将生成的气体用碱石灰吸收,称量,
测得生成的CO2的质量为m5 g,用m4、m5计算出Na2CO3的纯度。
回答下列问题;
(1) 方案I中依次发生的反应的离子方程式是:?、?
(2) 方案Ⅱ中,怎样检验加入的BaCl2溶液已过量,请简述操作方法:
?
(3) 方案Ⅲ和Ⅳ中都有CO2生成,不需要干燥就可测定CO2体积或质量的是方案.??(填序号);若生成的CO2部分残留在反应容器中,会使实验结果产生误差的是方案??(填序号),此误差会使测得的Na2CO3的纯度?(填“偏大”或“偏小”)。
(4) 不用任何化学试剂(除样品外),请你再设计一个实验方案,测定该纯碱样品中Na2CO3的纯度?
参考答案:

本题解析:命题意图:考察学生对试验的分析能力。
思路点拨:本题是一个选择性试验,要求学生对题目的要求有个很深的认识。,对实验现象的考查,既可以是直接由实验现象得出正确的结论,也可以是将实验的方法与正确的结论联系起来进行设问。对实验结果的分析,一般要求考生分析实验的关键细节以及产生的误差等等。实验结果的处理,既可能直接报告数据。
本题难度:简单
3、填空题 (6分)已知:
①某银白色固体A,放在空气中可氧化成白色固体B
②将A点燃,火焰呈黄色,生成淡黄色固体C
③A、B、C三种物质都能跟无色液体D反应,生成碱性物质E,其中A跟D反应时还
可生成可燃性气体F,C跟D反应时则生成另一种气体G
④F和G混合后遇火可剧烈反应而发生爆炸,并生成D。
完成下列问题:
(1) C的名称为______________,A与D反应的类型属于?。
(2)写出下列反应的化学方程式
A→B?
C→E?
参考答案:(6分)(1)过氧化钠?置换反应?(各1分)
(2)4Na +O2 =2Na2O?(2分)?2Na2O2 + 2H2O="4NaOH" +O2↑(2分)
本题解析:考查钠及其化合物的性质和相互的转化等。
根据反应的应该现象及有关性质可知,A是钠,B是氧化钠,C是过氧化钠,D是水,E是氢氧化钠,F是氢气,G是氧气。钠与水反应生成氢氧化钠和氢气的反应是置换反应。其中A生成B和C生成E的反应方程式分别是4Na +O2 =2Na2O、2Na2O2 + 2H2O="4NaOH" +O2↑。
本题难度:一般
4、填空题 呼吸面具里有Na2O2,可吸收CO2放出O2,若用超氧化钾(KO2)代替过氧化钠,也能吸收CO2生成碳酸盐和O2。
(1)写出KO2与CO2反应的化学方程式。
(2)1 kg Na2O2和1 kg KO2与CO2反应生成O2的质量分别为__________。
(3)你认为选用_________作为氧化剂更为合适,理由是____________。
参考答案:(1)4KO2+2CO2====2K2CO3+3O2
(2)205 g 338 g
(3)KO2 等质量时,KO2产生O2多
本题解析:(1)由题给信息分析KO2和CO2反应的生成物为K2CO3和O2,并配平该化学方程式。
(2)由2Na2O2—O2?4KO2—3O2
156? 32? 284? 96
1 kg? x? 1 kg? y
解得x="0.205" kg y="0.338" kg。
(3)利用(2)中搭设的台阶,可知等质量时KO2产生O2质量更多,故选KO2更合适。
本题难度:简单
5、实验题 工业生产纯械的工艺流程示意图如下

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
参考答案:(每空2分,第(1)问1分,共计15分)(1)Na2CO3
(2)NH3;因为在CO2水中的溶解度小,而NH3溶解度大
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)NH4Cl;增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出
(5)2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O; 
本题解析:(1)粗盐提纯时需要除去的杂质离子是Ca2+、Mg2+,A来源于石灰窑厂,则A是生石灰或熟石灰,用来除去Mg2+,而Ca2+一般用碳酸钠来除去,即B试剂是碳酸钠。
(2)由于在CO2水中的溶解度小,而NH3溶解度大,所以要先通入氨气,然后再通入CO2气体。
(3)由于碳酸氢钠的溶解度较小,所以向氨气饱和的氯化钠溶液中通入CO2气体会产生碳酸氢钠晶体,反应的化学方程式是NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(4)由于溶液中含有氯离子和NH4+,所以加入细小食盐颗粒,增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出,因此析出副产品是氯化铵。
(5)碳酸氢钠稳定性差,在加热的条件下能发生分解,反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后)],因此根据方程式可知,纯碱中碳酸氢钠的质量为
Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后)],因此根据方程式可知,纯碱中碳酸氢钠的质量为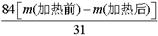 ,所以纯碱中含有的碳酸氢钠的质量分数为
,所以纯碱中含有的碳酸氢钠的质量分数为 。
。
本题难度:一般