微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2═2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为______
②正极反应式为______
③工作一段时间后,溶液pH______(填“增大”或“减小”或“不变”)
(2)如把KOH改为稀H2SO4作电解质,则:
①负极反应式为______
②正极反应式为______
③工作一段时间后,溶液pH______(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为______.
参考答案:(1)①该反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O.
②氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
③随着反应的进行,生成的水越来越多,溶质氢氧化钾的量不变,所以导致溶液的浓度降低,所以溶液的PH值减小.
故答案为:①2H2+4OH--4e-=4H2O;②O2+2H2O+4e-=4OH-; ③减小.
(2)该反应中氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+
②氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;
③随着反应的进行,生成的水越来越多,溶质硫酸的量不变,所以导致溶液的浓度降低,所以溶液的PH值增大.
故答案为:①2H2-4e-═4H+;②O2+4H++4e-═2H2O;③增大.
(3)负极上甲烷燃烧生成二氧化碳和水,甲烷失电子发生氧化反应生成二氧化碳,二氧化碳和溶液中的氢氧化钾反应生成碳酸钾和水;
正极上氧气得电子和水反应生成氢氧根离子,所以电极反应式为.O2+2H2O+4e-═4OH-.
故答案为:O2+2H2O+4e-═4OH-.
本题解析:
本题难度:一般
2、简答题 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
| 金属 | 电子流动方向 | 电压/V
A
A→Cu
+0.78
B
Cu→B
-0.15
C
C→Cu
+1.35
D
D→Cu
+0.30
|
已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请根据表中数据回答下列问题.
(1)______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜.
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的金属是______(填字母).其对应电池的电极反应式为:负极:______;?正极:______.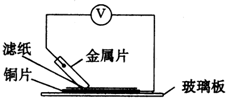
参考答案:A-Cu连接时,电子从A→Cu,所以A的金属性大于铜;
?B--Cu连接时,电子从Cu→B,所以铜的金属性大于B;
?C--Cu连接时,电子从C→Cu,所以C的金属性大于铜;
? D--Cu连接时,电子从D→Cu,所以D的金属性大于铜;
(1)根据题中信息和原电池原理,电子流出的一极是原电池的负极,是相对活泼的金属,所以A、C、D都比Cu活泼,金属活动性差值越大,电压表的示数越大.所以C最活泼,而活泼性比Cu差的是B.故答案为:C;B;
(2)滤纸改为用NaOH溶液浸润,若生成蓝色沉淀[Cu(OH)2],说明Cu作负极,则B作正极,
负极反应为:2Cu+4OH--4e-═2Cu(OH)2↓;正极反应为:2H2O+O2+4e-═4OH-.
故答案为:B;2Cu+4OH--4e-═2Cu(OH)2↓;2H2O+O2+4e-═4OH-.
本题解析:
本题难度:一般
3、选择题 某实验兴趣小组以Zn和Cu为电极,稀硫酸为电解质溶液研究原电池,并对实验进行了拓展,以下实验记录错误的是( )
A.铜片上有气泡产生,锌片逐渐溶解
B.电子在溶液中从Cu电极流向Zn电极
C.把锌片换成石墨,电流计指针没有明显偏转
D.把稀硫酸换成硫酸铜溶液,电流计指针依然偏转
参考答案:以Zn和Cu为电极,稀硫酸为电解质溶液构成的原电池中,金属锌做负极,金属铜做正极.
A、铜片正极上会析出氢气即有气泡产生,负极锌片逐渐溶解,故A正确;
B、电子不能经过电解质,而是沿导线从负极流向正极,故B错误;
C、把锌片换成石墨,仍具备原电池的构成条件,会产生电流,故C正确;
D、以Zn和Cu为电极,硫酸铜为电解质溶液,仍具备原电池的构成条件,可以形成原电池,会产生电流,故D正确.
故选B.
本题解析:
本题难度:一般
4、选择题 A、B、C都是金属,A和C分别放入同浓度的稀硫酸中,A的反应速率比C快,A与B和硫酸铜溶液组成原电池时,A的质量增加.A、B、C三种金属的活动性顺序为( )
A.A>B>C
B.A>C>B
C.B>A>C
D.C>A>B
参考答案:A、B、C都是金属,相同条件下,金属性越强的金属置换出氢气的反应速度越快,A和C分别放入同浓度的稀硫酸中,A的反应速率比C快,所以A的金属性比C强;
原电池放电时,较活泼金属作负极,负极上金属失电子生成金属阳离子进入溶液,导致负极质量减少,正极上溶液中铜离子得电子生成铜单质,导致正极质量增加,A与B和硫酸铜溶液组成原电池时,A的质量增加,A做正极,B作负极,所以B的金属性比A强,所以A、B、C三种金属的活动性顺序为B>A>C.
故选C.
本题解析:
本题难度:一般
5、填空题 (8分)在以铁、铜为两电极的原电池中,如图所示:
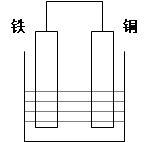
(1)若电解质溶液为稀硫酸,则铜电极上的电极反应式为: ;原电池总反应的离子方程式: ;
(2)若电解质溶液为浓硝酸, 则铁电极上的电极反应式为: ;当电路中通过了1mol的电子时,则在某极上生成了标准状况下的气体体积为: L。
参考答案:(1) 2H++2e-= H2↑;2H++Fe= Fe2++H2↑;
(2) NO3-+2H++e-= NO2↑+ H2O;22.4。
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。铁比铜活泼,铁是负极,铜是正极,溶液中的氢离子得到电子。
(2)如果是浓硝酸,由于铁会发生钝化,所以作负极的是铜,失去电子而溶解。铁是正极,溶液中的NO3-得到电子,反应式为NO3-+2H++e-= NO2↑+ H2O。根据电极反应式可知,当电路中通过了1mol的电子时,生成NO2的体积在标准状况下为22.4L。
本题难度:一般