微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 合成氨工业的核心反应是:
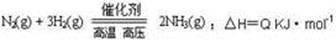
能量变化如右图,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量 (填“<”、“>”或“=”)46.2kJ;
(3)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S< 0 C.△H<0,△S>0 D.△H<0,△S<0(4)将一定量的N2(g)和H2(g)放入 1L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol。计算该条件下达到平衡时H2转化为NH3的转化率 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨
参考答案:(1)减小;?减小
(2)<
(3)D
(4)33.3%;减小
(5)A、D
本题解析:(1)加入催化剂,能降低反应所需的活化能,但不影响反应热,即,E1和E2的均减小;
(2)该反应为可逆反应,反应物不能完全转化为生成物,所以,充入0.5mol N2和1.5mol H2,充分反应后,放出的热量小于46.2kJ;
(3)该反应为放热反应,所以△H<0,又该反应为气体体积增大的反应,所以△S<0;
(4)33.3%;该反应为放热反应,升高温度平衡向逆反应方向移动,即K减小
(5)提高合成氨中H2的转化率即使平衡向正反应方向移动;所以,可选的有;A、D
本题难度:一般
2、选择题 下列图示中关于铜电极的连接错误的是
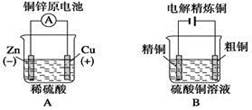 ?
?
参考答案:C
本题解析:镀件上镀铜时,铜应作阳极,与电源正极相连,镀件作阴极,与电源负极相连。答案选C。
本题难度:一般
3、选择题 在理论上可用来设计原电池的反应是
A.Fe +2HCl =" Fe" Cl2+ H2
B.NaOH +HCl="NaCl+" H2O
C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4
D.Ca CO3+2HCl=" Ca" Cl2+ H2O+ CO2
参考答案:A
本题解析:常温能自发进行的氧化还原反应可设计成原电池,有元素化合价变化的反应为氧化还原反应,以此来解答。A中反应是置换反应,属于氧化还原反应,能用于设计原电池,A正确;B中反应是中和反应、C和D中都是复分解反应,反应中没有元素的化合价变化,不是氧化还原反应,因此不能用于设计原电池,故BCD均不符合题意,因此答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础知识的巩固和训练。明确能自发进行的氧化还原反应能设计成原电池是解答本题的关键,准确判断出反应中有关元素的化合价变化是前提。
本题难度:简单
4、选择题 有关如图装置的叙述不正确的是( )
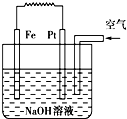
A.这是电解NaOH溶液的装置
B.该装置中Pt为正极,电极反应为O2+2H2O+4e-→4OH-
C.该装置中Fe为负极,电极反应为Fe-2e-+2OH-→Fe(OH)2
D.这是一个原电池装置
参考答案:A.没有外加电源,为原电池,故A错误;
B.Fe为负极,Pt为正极,发生吸氧腐蚀,则正极反应为O2+2H2O+4e-→4OH-,故B正确;
C.负极Fe失去电子,则负极反应为Fe-2e-+2OH-→Fe(OH)2,故C正确;
D.由电极、电解质形成闭合回路,构成原电池,故D正确;
故选A.
本题解析:
本题难度:简单
5、选择题 有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应为:2H2+O2===2H2O,负极反应:H2+CO32--2e-===H2O+CO2。下列说法正确的是
A.电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路
B.电池放电时,电池中CO32-的物质的量将逐渐减少
C.正极反应为2H2O+O2+4e-===4OH-
D.放电时CO32-向负极移动
参考答案:D
本题解析:A、原电池中电子只能通过导线传递,溶液中是靠离子的移动而导电,因此该原电池中电子从负极传递到正极,不经过熔融的碳酸钾,A不正确;B、根据电池的电池的总反应式2H2+O2===2H2O可知,电池放电时,电池中CO32-的物质的量不变,B不正确;C、总反应减去负极反应即得到正极反应式,所以正极反应式为2CO2+O2+4e-===2CO32-,C不正确;D、原电池中电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,阴离子则向负极移动,D正确,答案选D。
本题难度:一般