微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3H2OAl2O3+3H2↑电解过程中,以下判断正确的是:
?
| ?电池
| ?电解池
|
A
| H+移向Pb电极
| H+移向Pb电极
|
B
| 每消耗3molPb
| 生成2molAl2O3
|
C
| 正极:PbO2+4H++2e—=Pb2++2H2O
| 阳极:2Al+3H2O-6e—=Al2O3+6H+
|
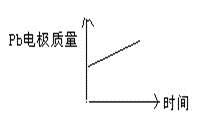
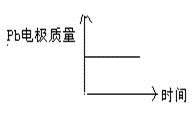
D
| 
| 
|
?
2、简答题 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
(1)电极b上发生的电极反应为______.
(2)电极b上生成的气体在标状况下的体积为______,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)______.
(3)电极c的质量变化是______g,欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的______(填字母编号).
A.Cu(OH)2?B.Cu2O?C.CuCO3?D.Cu2(OH)2CO3
(4)其他条件不变,如果把乙装置改为电解精炼铜,则c电极的材料为______,d电极的材料为______.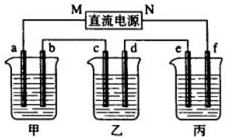
3、选择题 日常用的电池为锌锰干电池,其电极分别为碳棒和锌壳,以糊状NH4Cl作电解质(其中加入MnO2氧化吸收H2),电极反应式为:Zn-2e-═Zn2+;2NH4++2e-═2NH3+H2.根据叙述试判断下列说法中正确的是( )
A.锌锰干电池中Zn为正极,碳棒为负极
B.锌锰干电池工作时,电子由碳极经外电路流向Zn极
C.锌锰干电池长时间连续使用时内装糊状物会流出腐蚀电器
D.锌锰干电池能将化学能转化为电能和将电能转化为化学能
4、选择题 如图所示装置,能够组成原电池且产生电流的是( )
A.

B.

C.
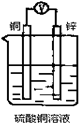
D.
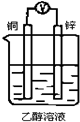
5、选择题 表明金属甲比金属乙活动性强的叙述正确的是
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子;甲比乙氧化性强
C.常温下甲能与浓HNO3反应而乙不能
D.将甲、乙组成原电池时,甲为负极