微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (7分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________________,写出H2O2在MnO2作用下发生反应的化学方程式:______________________________。

(2) 定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是_? _______________。
参考答案:(1)?反应产生气泡的快慢 (1分)?控制阴离子相同,排除阴离子的干扰 (1分)
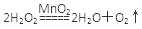 ?(2分)
?(2分)
(2) 分液漏斗(1分)?收集40 mL气体所需要的时间(2分)
本题解析:首先明确实验目的:比较Fe3+和Cu2+对H2O2分解的催化效果;
(1)图甲:两试管中盛有等体积、等浓度的H2O2,分别滴入氯化铁、硫酸铜溶液,通过产生气泡的快慢即可比较Fe3+和Cu2+对H2O2分解的催化效果(保持其他条件相同,只改变催化剂);
氯离子中氯为-1价,有还原性,H2O2有氧化性,故Cl-和H2O2可发生氧化还原反应,应排除Cl-的干扰;
(2)“收集40 mL气体所需要的时间”即通过计算分别用Fe3+、Cu2+催化时生成O2的速率,来定量比较Fe3+和Cu2+对H2O2分解的催化效果;
本题难度:一般
2、选择题 升高温度,下列数据不一定增大的是
A.化学反应速率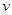
B.KNO3的溶解度S
C.化学平衡常数K
D.水的离子积常数Kw
参考答案:C
本题解析:A.在其它条件不变的情况下,升高温度化学反应速率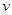 ?加快。不符合题意。错误。B.KNO3的溶解度S受温度的影响变化较大,升高温度,促进KNO3的溶解,所以KNO3的溶解度S增大。不符合题意。错误。C.化学平衡常数K只与温度有关。在其它条件不变的情况下,升高温度,化学平衡向吸热反应方向移动。如果可逆反应的正反应为放热反应,则升高温度,化学平衡向逆反应方向移动,K减小。如果可逆反应的正反应为吸热反应,则升高温度,化学平衡向正反应方向移动,K增大。所以升高温度化学平衡常数K。正确。D.水是弱电解质,升高温度,促进水的电离,水的离子积常数Kw增大。不符合题意。错误。
?加快。不符合题意。错误。B.KNO3的溶解度S受温度的影响变化较大,升高温度,促进KNO3的溶解,所以KNO3的溶解度S增大。不符合题意。错误。C.化学平衡常数K只与温度有关。在其它条件不变的情况下,升高温度,化学平衡向吸热反应方向移动。如果可逆反应的正反应为放热反应,则升高温度,化学平衡向逆反应方向移动,K减小。如果可逆反应的正反应为吸热反应,则升高温度,化学平衡向正反应方向移动,K增大。所以升高温度化学平衡常数K。正确。D.水是弱电解质,升高温度,促进水的电离,水的离子积常数Kw增大。不符合题意。错误。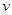 、物质的溶解度S、化学平衡常数K、水的离子积常数Kw的影响。
、物质的溶解度S、化学平衡常数K、水的离子积常数Kw的影响。
本题难度:一般
3、填空题 对于下列2个反应的说法正确的:
(1)2A2+B2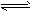 2C (均为无色)______________
2C (均为无色)______________
(2)X2+Y2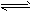 2XY 其中Y2是有色物质_____________
2XY 其中Y2是有色物质_____________
① 若物质均为气体,某物质的浓度、百分含量、物质的量不变了,反应达到了平衡状态
② 若物质均为气体V正(A2)= 2V逆(B2)时反应达到了平衡
③ 若物质均为气体,V逆(X2)= 1/2V正(XY)时反应达到了平衡
④ ①式其他条件不变,若增大压强,平衡逆向移动,说明A、B中至少有一各是固体或液体
⑤ ②式平衡时,c(XY)=0.5mol/L, 若将容器体积扩大到原来的2倍,XY的的浓度变为0.3mol/L,则
X2、Y2中至少有一种是固体或液体。
⑥ 体系的温度不变了反应达到了平衡状态
⑦ 若物质均为气体,体系的颜色不变了,反应达到了平衡状态
⑧ 若物质均为气体,体系的平均分子量不变了,反应达到了平衡状态
参考答案:(1)①②⑥⑧
(2)①③⑤⑥⑦
本题解析:
本题难度:一般
4、选择题 在一个不传热的固定容积的密闭容器中,可逆反应N2(气)+3H2?(气)

2NH3(气)+Q达到平衡的标志是( )
a.反应速率υ(N2):υ(H2):υ(NH3)=1:3:2;
b.各组分的物质的量浓度不再改变;
c.体系的压强不再发生变化;
d.混合气体的密度不变(相同状况);
e.体系的温度不再发生变化;
f.2υ(N2)?(正反应)=υ(NH3)(逆反应);
g.单位时间内?3mol?H-H键断裂的同时有6mol?N-H键断裂.
A.abcef
B.bcdef
C.bcefg
D.bcdfg
参考答案:a.无论是否达到平衡状态,化学反应速率之比都等于化学计量数之比,故a错误;
b.当反应达到平衡状态时,各组分的物质的量浓度不再改变,故b正确;
c.反应前后气体的化学计量数之和不想等,当达到平衡状态时,压强不变,故c正确;
d.反应前后气体的质量不变,容器的体积不变,无论是否达到平衡状态,气体的密度都不变,不能作为判断是否达到平衡状态的依据,故d错误;
e.反应达到平衡状态时,反应物的物质的量不再发生改变,体系的温度不变,故e正确;
f.2υ(N2)?(正反应)=υ(NH3)(逆反应),说明正逆反应速率相等,达到平衡状态,故f正确;
g.单位时间内?3molH-H键断裂的同时有6molN-H键断裂,说明正逆反应速率相等,达到平衡状态,故g正确.
故选C.
本题解析:
本题难度:一般
5、选择题 一定温度下,在2 L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
时间(s)
| 0
| 500
| 1000
| 1500
|
t1℃
| 20
| 13.96
| 10.08
| 10.08
|
t2℃
| 20
| a
| b
| c
|
?
下列说法一定正确的是(?)
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1 000 s至1 500 s之间
D.如果t2℃>t1℃,那么b>10.08
参考答案:D
本题解析:A项,温度越低,平衡常数越大,说明正反应为放热反应,错误;B项,降温,反应速率减慢,1 000 s时未平衡,b与c不相等,错误;C项,t2℃时,由于反应速率减小,达到平衡所用时间长,大于1 000 s,但无法确定达到平衡所需时间;D项,升温,平衡左移,致使b>10.08,正确。
本题难度:一般