|
高考化学知识点总结《难溶电解质的溶解平衡》考点巩固(2017年最新版)(十)
2017-09-24 00:10:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断
|
参考答案:A
本题解析:在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,NH4Cl溶于水水解:NH4Cl+ H2O NH3·H2O+HCl,导致溶液呈酸性,Mg(OH)2能够溶于酸,Mg(OH)2+2HCl==MgCl2+2H2O,故A项正确。 NH3·H2O+HCl,导致溶液呈酸性,Mg(OH)2能够溶于酸,Mg(OH)2+2HCl==MgCl2+2H2O,故A项正确。
考点:水解平衡应用。
本题难度:一般
2、实验题 (15分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、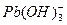 、 、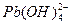 ,各形态的浓度分数α随溶液pH变化的关系如下图所示: ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
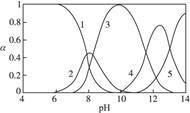
1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示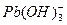 ,5表示 ,5表示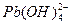
(1)Pb(NO3)2溶液中 ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,  增大,可能的原因是_____________。 增大,可能的原因是_____________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时主要反应的离子方程式为______________。
参考答案:(1)>? Pb2+与Cl-发生反应,使c(Pb2+)减小
(2)Pb2+、Pb(OH)+、H+? Pb2++2OH-====Pb(OH)2↓
本题解析:
(1)因为Pb(NO3)2是一种强酸弱碱盐,在水溶液中存在如下水解平衡:2H2O+Pb2+ Pb(OH)2+2H+,使c(Pb2+)减小,所以 Pb(OH)2+2H+,使c(Pb2+)减小,所以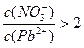 。 。
(2)pH=8时,曲线上1、2、3表示的物质共存,所以此时溶液中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+和H+。pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2。
本题难度:简单
3、选择题 已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是 (? )
A.所得溶液中的c(H+)=1.0×10-12 mol·L-1
B.所加的烧碱溶液pH=12.0
C.所得溶液中由水电离产生的c(OH-)=1.0×10-12 mol·L-1
D.所得溶液中的c(Mg2+)=5.6×10-8 mol·L-1
参考答案:B
本题解析:A、pH=12.0,所以c(H+)=10-12 mol/L;B、两溶液混合后c(OH-)="0.01" mol/L,所以烧碱中c(OH-)更大,故其pH>12,C、加碱抑制水的电离,所以水电离出的c(OH-)=10-12mol/L);D、c(OH-)="0.01" mol/L,故c(Mg2+)=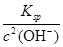 =5.6×10-8mol/L。 =5.6×10-8mol/L。
本题难度:一般
4、实验题 某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题。
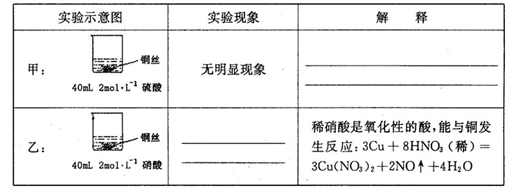
(1)在甲、乙两个烧杯中,分别装入40mL浓度均为2mol·L-1的稀硫酸和稀硝酸,并向其中各加入 4g束状铜丝,观察现象,试完成下列实验报告:
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为____ ,剩余固体总质量为 g
(3)若甲中硫酸溶液体积V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=____ mL,若要将溶液中的Cu2+沉淀完全,应加NaOH使溶液的pH至少为____ 。已知KsP[Cu(OH)2]=2.2×l0-20,1g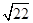 =0.7) =0.7)
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解? 试写出推理过程________ 。
参考答案:26.(1)甲:稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来
(1分)。 乙:铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝(1分);
(2)CuSO4,Cu(NO3)2(2分);2.24(2分)(3)①60(2分) 6.7(2分)②否(1分)。(3分)
本题解析:(1)甲:由于稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,所以不能将氢置换出来。乙:由于硝酸是氧化性酸,能氧化金属铜,因此实验现象是铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝。
(2)硝酸和硫酸的物质的量是0.04L×2mol/L=0.08mol,其中NO3-的物质的量是0.08mol,氢离子的物质的量是0.24mol,根据方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知氢离子不足,NO3-过量,所以能溶解铜的质量= ×0.24mol×64g/mol=5.76g<8g,所以铜过量,剩余铜的质量=8g-5.76g=2.24g,1其中溶液中最终所得溶液溶质为CuSO4、Cu(NO3)2。 ×0.24mol×64g/mol=5.76g<8g,所以铜过量,剩余铜的质量=8g-5.76g=2.24g,1其中溶液中最终所得溶液溶质为CuSO4、Cu(NO3)2。
(3)①若溶液中溶质只有一种,则该溶质应该是硫酸铜。根据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,需要氢离子的物质的量是0.08mol×4=0.032mol,其中硫酸提供的氢离子是0.032mol-0.08mol=0.24mol,所以硫酸的物质的量=0.24mol÷2=0.12mol,则硫酸溶液的体积=0.12mol÷2mol/L=0.06L=60ml。当溶液中铜离子浓度小于或等于10-5mol/L时可以看作铜离子完全沉淀,则根据溶度积常数可知,此时溶液中c(OH-)=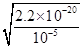 = =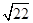 ×10-8mol/L,则c(H+)= ×10-8mol/L,则c(H+)=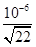 ,因此pH=6+1g ,因此pH=6+1g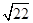 =6.7。 =6.7。
②乙烧杯的中的NO3-共40mL×10-3L/mL×2mol/L=0.08mol,据离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,最多可氧化的Cu的质量为0.08mol× ×64g/mol=7.68g,小于两烧杯中铜丝的总质量,故无法让铜溶解完。 ×64g/mol=7.68g,小于两烧杯中铜丝的总质量,故无法让铜溶解完。
考点:考查铜、硝酸、硫酸的性质;铜与硝酸反应的计算;溶度积常数的应用等
本题难度:困难
5、选择题 下列有关AgCl沉淀的溶解平衡的说法中,不正确的是
[? ]
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
参考答案:B
本题解析:
本题难度:一般
|