微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将足量的AgI固体分别放入下列物质中,AgI的溶解度由大到小的排列顺序是( )
①5mL0.001mol?L-1KI溶液?
②15mL0.002mol?L-1CaI2溶液
③35mL0.003mol?L-1HI溶液?
④15mL蒸馏水?
⑤45mL0.005mol?L-1AgNO3溶液.
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:AgI在溶液中存在溶解平衡:AgI(s)?Ag+(aq)+I-(aq),由于c(Ag+)或c(I-)对溶解平衡有抑制作用,则溶液中c(Ag+)或c(I-)越大,则AgI的溶解度越小:
①c(I-)=0.001mol/L,②c(I-)=0.004mol/L,③c(I-)=0.003mol/L,④c(I-)=0,⑤c(Ag+)=0.005mol/L,
则c(Ag+)或c(I-)由大到小的顺序为⑤>②>③>①>④,
所以AgI的溶解度由大到小的排列顺序是④>①>③>②>⑤,
故选B.
本题解析:
本题难度:一般
2、简答题 用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下:
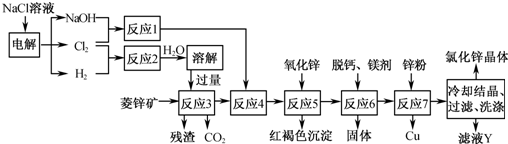
(1)在反应3前要将菱锌矿研磨,其目的是______.
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______.
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为______、______.
(4)锌粉不在反应4之前加入的原因是______.
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有______.
参考答案:(1)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,故答案为:增大反应物接触面积,使反应3反应速率加快;
(2)反应1是氯气与氢氧化钠溶液反应,产物是NaClO、NaClO3和水,反应3中加入了过量盐酸,反应4中将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(3)加入氧化锌调节溶液的pH=4.5,同时得到红褐色沉淀Fe(OH)3,同时不引入新的杂质;反应的离子方程式为:ZnO+2H+═Zn2++H2O,Fe3++3H2O?Fe(OH)3↓+3H+,
故答案为:ZnO+2H+═Zn2++H2O;Fe3++3H2O?Fe(OH)3↓+3H+;
(4)因为菱锌矿中含有杂质离子Fe3+,以及加入的盐酸均可以与锌粉反应,这样锌的用量增加,并造成后续反应中所用的次氯酸钠或氯酸钠的用量也增加,
故答案为:Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量;
(5)滤液Y是ZnCl2,用石墨作电极,电解时首先得到H2和Cl2,当ZnCl2浓度较大时还可以得到Zn,故答案为:H2、Cl2、Zn.
本题解析:
本题难度:一般
3、选择题 已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol?L-1
B.加入Na2CO3固体,可能生成沉淀
C.所加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10mol?L-1
参考答案:A.pH=13的溶液中,c (H+)=10-13mol/L,故A正确;
B.加入Na2CO3固体,当c(Mg2+)×c(CO32-)>ksp(MgCO3)时,生成沉淀,故B正确;
C.因为向MgCl2溶液中加NaOH溶液后混合溶液的pH=13,所以所加NaOH溶液pH>13,故C错误;
D.溶液中的c (Mg2+)=5.6×10-12÷10-2=5.6×10-10 mol/L,故D正确.
故选C.
本题解析:
本题难度:简单
4、选择题 下列说法中正确的是( )
A.硬水的暂时硬度比永久硬度对锅炉的危害大
B.凡含有Ca2+、Mg2+的水叫硬水
C.离子交换法只能软化永久硬水
D.硬水中的Ca2+、Mg2+离子经煮沸就会完全沉淀下来
参考答案:A、硬水的暂时硬度是有碳酸氢钙、碳酸氢镁引起的硬度,加热时会生成碳酸钙、氢氧化镁沉淀,附着在锅炉内壁,阻碍传热,多耗燃料,甚至局部过热,损毁锅炉,引起爆炸,永久硬水不会加热时产生沉淀,所以比永久硬度对锅炉的危害大,故A正确;
B、不是所有含钙镁离子的水都叫硬水;通常,如果1L水里含有10mg CaO或相当于10mg CaO的物质,例如7.1mg MgO,那么这样的水的硬度称为1度.通常硬度在0-4度称为很软水,4-8度称为软水,8-16度称为中硬水,16-30度称为硬水,30度以上称为很硬水,故B错误;
C、离子交换法采用特定的阳离子交换树脂,以钠离子将水中的钙镁离子置换出来,由于钠盐的溶解度很高,所以就避免了随温度的升高而造成水垢生成的情况,所以可以软化永久硬水和暂时硬度的水,故C错误;
D、硬水中的Ca2+、Mg2+离子形成的暂时硬度,经煮沸就会完全沉淀下来;但永久硬度的水不能加热煮沸除去,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 已知AgCl能溶于氨水而生成[Ag(NH3)2]+.NH4Cl溶液和AgNO3溶液混合后,再滴入NaOH溶液,溶液中沉淀量y与NaOH溶液加入量x的关系曲线不可能是( )
A.
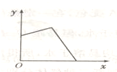
B.

C.

D.

参考答案:分析时应注意考虑到NH4Cl溶液和AgNO3溶液混合后,二者是否能恰好反应完,若不能,AgNO3是否过量,因为Ag+在碱性条件下可生成AgOH沉淀.
A、若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH4+的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,故A错误;
B、若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH4+的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,故B正确;
C、若混合前n(NH4Cl)≥2n(AgNO3),加入足量NaOH后沉淀全部溶解,故C正确;
D、若2n(AgNO3)>n(NH4Cl)>n(AgNO3),加入一定量NaOH溶液,沉淀部分溶解,故D正确;
故选A.
本题解析:
本题难度:简单