|
高考化学知识点总结《难溶电解质的溶解平衡》考点巩固(2017年最新版)(九)
2017-09-24 00:10:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀
A.溶解
B.增多
C.不变
D.无法判断
|
2、实验题 (15分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、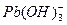 、 、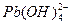 ,各形态的浓度分数α随溶液pH变化的关系如下图所示: ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
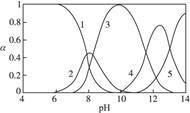
1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示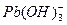 ,5表示 ,5表示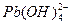
(1)Pb(NO3)2溶液中 ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,  增大,可能的原因是_____________。 增大,可能的原因是_____________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时主要反应的离子方程式为______________。
3、选择题 已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=12.0,则下列说法不正确的是 (? )
A.所得溶液中的c(H+)=1.0×10-12 mol·L-1
B.所加的烧碱溶液pH=12.0
C.所得溶液中由水电离产生的c(OH-)=1.0×10-12 mol·L-1
D.所得溶液中的c(Mg2+)=5.6×10-8 mol·L-1
4、实验题 某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题。
(1)在甲、乙两个烧杯中,分别装入40mL浓度均为2mol·L-1的稀硫酸和稀硝酸,并向其中各加入 4g束状铜丝,观察现象,试完成下列实验报告:
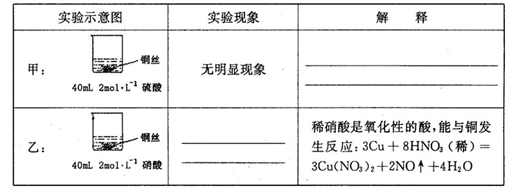
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为____ ,剩余固体总质量为 g
(3)若甲中硫酸溶液体积V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=____ mL,若要将溶液中的Cu2+沉淀完全,应加NaOH使溶液的pH至少为____ 。已知KsP[Cu(OH)2]=2.2×l0-20,1g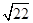 =0.7) =0.7)
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解? 试写出推理过程________ 。
5、选择题 下列有关AgCl沉淀的溶解平衡的说法中,不正确的是
[? ]
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
|