微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知氨水的电离程度与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(固)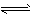 Mg2++2OH-①
Mg2++2OH-①
NH4++H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH-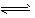 H2O③
H2O③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(固) Mg2++2OH-①
Mg2++2OH-①
NH4++OH-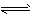 NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是____(填写编号)。
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3·H2O
(2)请你说明丙同学作出该选择的理由_____________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 ____(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式______________。
参考答案:(1)B
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2悬浊液,若 Mg(OH)2溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确
(3)乙; Mg(OH)2+2NH4+=Mg2++2NH3·H2O
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.两种难溶物中溶解度小的物质其KSP不一定小
B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大
C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀
D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>①
参考答案:A
本题解析:A、溶解度与KSP的换算和化学式的系数和摩尔质量有关,所以两种难溶物中溶解度小的物质其KSP不一定小,正确;B、有些酸式盐的溶解度小于正盐的溶解度,如NaHCO3的溶解度小于Na2CO3的溶解度,错误;C、向BaSO4悬浊液中加入饱和Na2CO3溶液,BaSO4沉淀转化为BaCO3,错误;D、相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>①>②,错误。
本题难度:一般
3、选择题 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的(?)

A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大
参考答案:D
本题解析:由图可知该条件下的CaSO4饱和溶液中溶度积常数K=9.0×10-6(mol/L)2,c(Ca2+)="c" (SO4-)=3.0×10-3mol/L,加入400mL 0.0lmol·L-l的Na2SO4溶液,溶液体积变为500mL,c(Ca2+)=3.0×10-3mol/L/5=6.0×10-4mol/L,c (SO4-)=(3.0×10-3mol/L×0.1L+0.01mol·L-l×0.4L)/0.5L=8.6×10-3mol/L,所以此时c(Ca2+)·c (SO4-)=5.16×10-6(mol/L)2<9.0×10-6(mol/L)2,溶液为不饱和溶液,所以无沉淀析出,排除AC;此时c (SO4-)= 8.6×10-3mol/L>3.0×10-3mol/L,答案选D。
本题难度:一般
4、选择题 已知某氢氧化物 的溶度积常数为
的溶度积常数为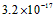 ,则
,则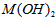 在水中的溶解度为
在水中的溶解度为
[? ]
A.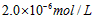
B.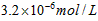
C.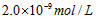
D.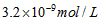
参考答案:A
本题解析:
本题难度:一般
5、填空题 物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。
请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_______________。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):
__________________;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________________________,目的
是________________________;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为____________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL
0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是___________________(填写序号);②中氯离子的浓度
为____________mol·L-1。
参考答案:(1)c(NH4+) > c(SO42-) > c(H+) >c(OH-)?
(2)HCO3- H++CO32-、HCO3+H2O
H++CO32-、HCO3+H2O H2CO3+OH-、H2O
H2CO3+OH-、H2O H++OH-;HCO3-的水解程度大于其电离程度,溶液中c(OH-) > c(H+),故溶液显碱性
H++OH-;HCO3-的水解程度大于其电离程度,溶液中c(OH-) > c(H+),故溶液显碱性
(3)盐酸;抑制Fe3+水解;Fe3++3HCO3-== Fe(OH)3↓+3CO2↑
(4)②①④③;9×10-10
本题解析:
本题难度:一般