|
|
|
高考化学知识点归纳《盐类水解的原理》试题强化练习(2017年最新版)(九)
2017-09-24 00:28:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl?) + c(ClO?) + c(OH?)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3?) > c(CO32?) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl?) = c(NH4+) > c(OH?) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: 2c(H+) – 2c(OH?) = c(CH3COO?) – c(CH3COOH)
2、选择题 常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是( )
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.c(Na+)+c(H+)>c(CH3COO-)+c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
|
3、选择题 常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
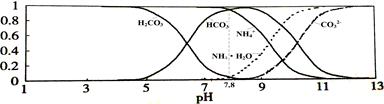
A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
|
4、填空题 X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。
用化学用语回答下列问题:
(1) M在元素周期表中的位置为 ;六种元素的原子半径从大到小的顺序是
(2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为 ,Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为 。
(3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因 。
(4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因 。
(5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:阳极: ;阴极: 。
5、选择题 下列有关溶液中微粒的物质的量浓度的关系,正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合的溶液:c(Cl-)>c(Na+)>c(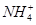 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(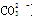 )
)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)
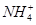 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)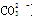 )
)