微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向硫酸亚铁与硫酸铝的混合溶液中加入足量的浓氨水,在空气中滤出所得沉淀,经洗净、干燥、灼烧,最终得到固体的成分是( )
A.Fe2O3、A12O3
B.Fe(OH)2、Al(OH)3
C.Fe(OH)3、A1(OH)3
D.FeO、A12O3
参考答案:A
本题解析:
本题难度:简单
2、填空题 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:
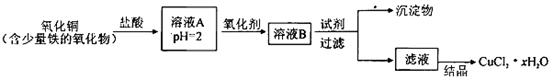
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4?②(NH4)2S?③NaOH?④ KSCN
(2)氧化剂可选用_________。①Cl2?②KMnO4?③HNO3?④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。

(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
参考答案:(1)①(2分) (2)①④(2分) (3)③④(2分) (4)②③①(2分)
(5)250ml容量瓶(2分);b(2分) (6)二(2分);晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解(2分);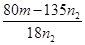 (2分)
(2分)
本题解析:(1)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液检验亚铁离子,①正确。(NH4)2S或NaOH与三种金属阳离子均反应不能检验亚铁离子,KSCN溶液只能检验铁离子,因此②③④均不正确,答案选①。
(2)由于在氧化亚铁离子时不能再引入新的杂质,氯气的还原产物是氯离子,双氧水的生成物是水,所以①④正确;氧化剂高锰酸钾会引入Mn2+、K+以及MnO4-,硝酸会引入NO3-,②③不正确,答案选①④。
(3)在调节pH值形成氢氧化铁沉淀时,仍然不能引入新的杂质。氢氧化钠会引入钠离子,氧化亚铁会引入亚铁离子,氧化铜和碱式碳酸铜与酸反应生成铜离子、水、CO2不会引入杂质,因此答案选③④。
(4)氯化铜易溶于水,所以从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶然后过滤即可,因此答案选②③①。
(5)要配制一定物质的量浓度的KMnO4溶液250mL,则除了需要天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要250ml容量瓶。酸性高锰酸钾溶液具有强氧化性与酸性,应该放在酸式滴定管中,因此答案选b。
(6)由于氯化铜是强酸弱碱盐,铜离子易水解生成氢氧化铜与氯化氢,水解吸热,且生成的氯化氢具有挥发,所以晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解,因此方案一是错误的,方案二正确。n2g固体是氧化铜,物质的量是 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是
mol,则根据铜原子守恒可知氯化铜晶体的物质的量是 mol,则
mol,则 mol×(135+18x)g/mol=mg,解得x=
mol×(135+18x)g/mol=mg,解得x=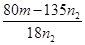 。
。
本题难度:一般
3、填空题 (6分)混合物由金属M的盐酸盐和其氧化合,以及另一种金属N的氧化物组成。有以下反应关系:

据此判断:
(1)沉淀D的化学式为___________________________________。
(2)反应③的化学方程式为________________________________。
(3)反应①②④的离子方程式为
①__________________________________________________,②___________________________________,④____________________________________。
参考答案:(1)Fe2O3
(2)2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
(3)①Al2O3+2OH-====2 +H2O
+H2O
②OH-+CO2=
 +2H2O+CO2====
+2H2O+CO2==== +Al(OH)3↓?
+Al(OH)3↓?
④Al3++3NH3·H2O====Al(OH)3↓+3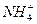
本题解析:由A中各物质的性质可推知B中含Al2O3和Fe2O3,C中溶质为KAl(SO4)2。反应④为Al3+与NH3·H2O生成Al(OH)3,故G为Al(OH)3。B中Al2O3与NaOH反应,故D为Fe2O3,E中含 和过量的OH-。由此推知,
和过量的OH-。由此推知, 与CO2反应生成Al(OH)3,这是由于Al(OH)3比H2CO3酸性弱的缘故,同时由于CO2过量,反应②应生成
与CO2反应生成Al(OH)3,这是由于Al(OH)3比H2CO3酸性弱的缘故,同时由于CO2过量,反应②应生成 。反应③为Al(OH)3受热分解生成Al2O3和H2O。
。反应③为Al(OH)3受热分解生成Al2O3和H2O。
本题难度:一般
4、实验题 浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气。
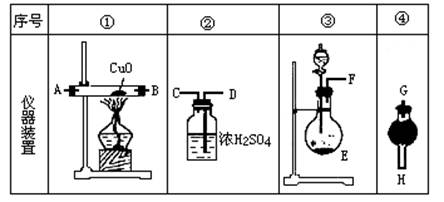
试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C……)____?____。
(2)E中发生反应的化学方程式是____?____。
(3)装置④中应当选用的干燥剂是(写名称)____?_______。
(4)装置①中发生氧化还原反应的化学方程式是___?________。其中氧化剂是____?__,氧化产物是______?__(写化学式)。
(5)装置②中浓硫酸的作用是_____?____。
参考答案:(1)F→G→H→A→B→D→C(A、B顺序可颠倒);(2)CaO+NH3·H2O=Ca(OH)2+NH3↑;(3)碱石灰;(4)2NH3+3CuO N2↑3H2O+3Cu;CuO;N2;(5)除去水蒸气和氨气。
N2↑3H2O+3Cu;CuO;N2;(5)除去水蒸气和氨气。
本题解析:本题综合考查运用氧化还原反应等知识,以及气体制取、干燥、尾气吸收等实验技能,解决新情境下化学实际问题的能力。本题中生成氨气和氨氧化反应的原理及产物,不难根据题给的条件确定,不再赘述。在此基础上,可依题目叙述的顺序,将各步的条件、任务与备选装置结合起来,找出相应的仪器装置,再合理连接起来,以完成整体实验装置的选择与组装。浓氨水与新制生石灰作用生成氨气,属于固体与溶液反应制气体,应选用装置③;“干燥的氨气”暗示接下来应该是干燥气体的装置。鉴于浓硫酸吸收氨气生成硫酸铵,不是干燥氨气,而是吸收氨气的装置,此干燥装置只能是④;氨气在高温下被氧化铜氧化,应使用装置①;根据题意“制取纯净的氮气”,可知最后应连接装置②,用浓硫酸吸收未被氧化的氨气及反应产生的水蒸气。应注意,作为洗气装置的③,气体应从D管进入,C管排出。
本题难度:简单
5、选择题 若向盛有氯化铁溶液的烧杯中同时加入铁和铜的混合粉末,反应结束后,下列不可能出现的结果是
A.铁、铜都有剩余,溶液中只有Fe2+
B.铁、铜都不剩余,溶液中可能有Fe3+、一定有Fe2+和Cu2+
C.铁有剩余、铜没剩余,溶液中只有Fe2+、Cu2+
D.铁没剩余、铜有剩余,溶液中一定没有Fe3+
参考答案:C
本题解析:略
本题难度:简单