微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:
2FeCl3 + Cu = 2FeCl2 + CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应
结束后,溶液中存在的金属阳离子不可能出现的是(?)
A.只有Fe2+
B.只有Fe2+、Cu2+
C.有Fe3+、Fe2+、Cu2+
D.只有Fe3+、Cu2+
2、选择题 某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每种方案所需试剂如下,你认为不可行的是( )
A.Fe、Ag、CuSO4溶液
B.Cu、Ag、FeSO4溶液
C.Fe、Cu、稀盐酸、AgNO3溶液?
D.Cu、FeC l2溶液、AgNO3溶液
3、填空题 (10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
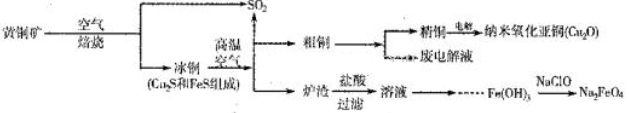
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-)
| 91:9
| 1:1
| 1:91
|
pH(25℃)
| 8.2
| 7.2
| 6.2
|
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。
4、选择题 下列叙述中,可用来判断元素金属性强弱的是?(?)
A.元素最高价氧化物对应水化物的碱性强弱
B.元素最高价氧化物对应水化物的酸性强弱
C.1 mol金属单质与酸反应失去电子的多少
D.1 mol金属单质与水反应放出氢气体积的多少
5、选择题 下列关于物质性质的叙述中,正确的是
[? ]
A.SO2的水溶液具有酸性、氧化性、还原性和漂白性
B.石灰石、高岭石、石英和水晶的主要成份都是硅酸盐
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe2+
D.硅是应用广泛的半导体材料,常温下易与氧气、氯气、硫酸等物质反应