| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《水的电离平衡》考点强化练习(2017年押题版)(四)
参考答案:D 本题解析:A、氯化铝是强酸弱碱盐,在氯化铝溶液中,氯化铝水解生成氢氧化铝和氯化氢,因为加热会促进水解正向移动,且氯化氢易挥发,所以水解会进行彻底,蒸干、灼烧至恒重,最终生成氧化铝,错误;B、向煮沸的1mol·L-1NaOH溶液中滴加FeCl3饱和溶液,得到氢氧化铁的沉淀,错误;C、一水合氨是弱碱,部分电离,在溶液中存在电离平衡。等体积pH=12的氨水和pH=12的NaOH溶液中,氨水的物质的量浓度大于氢氧化钠,所以氨水中和HCl的物质的量多,错误;D、碳酸钙比硫酸钙更难溶,硫酸钙存在溶解平衡,当加入饱和碳酸钠溶液后,碳酸根离子与钙离子结合为碳酸钙,发生沉淀转化,使硫酸钙的溶解平衡正向移动,则硫酸钙逐渐转化为碳酸钙,碳酸钙再用酸除去,正确,答案选D。 本题难度:一般 5、填空题 (10分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
(2)右图表示50 mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。 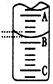 (3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为V mL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积; B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液; C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗; D.锥形瓶预先用食用白醋润洗过; E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。 (4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简): c= mol/L。 参考答案:(共10分) 本题解析:(1)食醋中的醋酸是弱酸,氢氧化钠是强碱,所以滴定后的溶液呈碱性,所以选择酚酞作指示剂; 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《元素周期律.. | |