微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号
| 待测NaOH溶液的体积/mL
| HCl溶液的体积/mL
|
1
| 25.00
| 24.41
|
2
| 25.00
| 24.39
|
3
| 25.00
| 22.60
|
回答下列问题:
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);
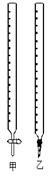
(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。
参考答案:(1)酸式 碱式
(2)酚酞(或甲基橙)黄色变成橙色且半分钟内不恢复原有的颜色(或 红色褪去且半分钟不再出现红色)
(3)偏高 偏低 (4)0.1288
本题解析:(1)酸式滴定管的开关是玻璃活塞,碱式滴定管的开关是橡胶管和玻璃珠。(2)标准酸滴定待测碱溶液选用酚酞或甲基橙指示剂均可以。酚酞 黄色变成橙色且半分钟内不恢复原有的颜色(或甲基橙 红色褪去且半分钟不再出现红色)
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,则标准酸溶液的体积读数大,测得碱的浓度偏高;若读酸式滴定管读数时,滴定前仰视读数,读数偏大,滴定后正确读数,计算酸的体积=末读数-初读数,偏小,测得碱的浓度偏低;(4)c(碱)=c(酸)V(酸)/V(碱)=0.1320mol/L×24.40ml/25.00 mL="0.1288" mol/L
考点:酸碱中和滴定实验操作和误差分析
本题难度:一般
2、实验题 (10分)已知草酸晶体( )可溶于水,并可与酸性高锰酸钾溶液完全反应:
)可溶于水,并可与酸性高锰酸钾溶液完全反应:
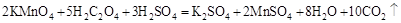
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定
| 第二次滴定
| 第三次滴定
|
待测溶液体积(mL)
| 25.00
| 25.00
| 25.00
|
标准溶液体积(mL)
| 9.99
| 10.01
| 10.00
|
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在 (填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是 (填序号)。
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是 。
(4)根据上述数据计算X= 。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 ;
②若KMnO4标准溶液浓度偏低,则X值 。
参考答案:(1)酸式(1分) (2)④⑥(2分)
(3)最后一滴标准液滴入锥形瓶中,溶液恰好由无色变成紫红色,且30秒内不褪色(3分)
(4)2(2分) (5)①偏高(1分) ②偏低(1分)
本题解析:(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;(2)配制一定物质的量浓度的溶液需要容量瓶、烧杯、玻璃棒,滴定过程需要滴定管夹,称量用分析天平,所以不需要的仪器有④⑥;(3)当最后一滴KMnO4溶液滴入时,溶液恰好由无色变成紫红色,且30秒内不褪去,说明滴定到终点;(4)第三次滴定偏差太大,应舍去,利用前两次滴定结果计算所用高锰酸钾溶液的体积为:10.00mL,1.260g草酸晶体所配草酸溶液中所含草酸的物质的量为:4× ×0.1000mol/L×0.010L=0.010mol,X=
×0.1000mol/L×0.010L=0.010mol,X= ×(
×( ?90)=2;(5)①滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,所测标准液体积变小,草酸物质的量变小,质量变小,则水偏多,X值偏高;②高锰酸钾标准液浓度偏低,所用标准液体积偏大,计算出的草酸物质的量偏多,质量偏大,水的质量偏小,X偏低。
?90)=2;(5)①滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,所测标准液体积变小,草酸物质的量变小,质量变小,则水偏多,X值偏高;②高锰酸钾标准液浓度偏低,所用标准液体积偏大,计算出的草酸物质的量偏多,质量偏大,水的质量偏小,X偏低。
考点:考查中和滴定。
本题难度:一般
3、选择题 下列操作能促进水的电离,且使溶液的pH>7的是
A.将纯水加热到90℃
B.向水中加少量Na2CO3溶液
C.向水中加少量NaOH溶液
D.向水中加少量FeCl3溶液