微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 19.2g Cu与过量的50 mL 18 mol·L-1浓硫酸加热完全反应后,
反应方程式如下: Cu + 2H2SO4(浓)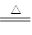 CuSO4 + SO2↑+ 2H2O 。
CuSO4 + SO2↑+ 2H2O 。
(1)得到SO2气体的体积(标准状况下)是 L;
(2)若反应后溶液中加入水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4 的物质的量浓度为 mol·L-1;
(3)往反应后溶液中加入足量的BaCl2,可以生成硫酸钡沉淀为 g。
参考答案:(1)6. 72 (2) 0.6 (3) 139.8
本题解析:19.2gCu为0.3mol,与足量浓硫酸生成0.3molSO2;同时生成0.3molCuSO4,将溶液稀释至500mL,物质的量浓度为0.6mol/L;反应后溶液中SO42-物质的量为(0.05×18-0.3)mol=0.6mol,向反应后的溶液中加入足量氯化钡溶液生成硫酸钡0.6mol。
考点:化学计算
点评:本题(3)应用元素守恒的思想。反应前硫总物质的量为0.9mol,生成SO2中S为0.3mol,所以残留溶液中SO42-为0.6mol。
本题难度:一般
2、简答题 实验室配制500mL?0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀.
回答下列问题:
(1)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有:______.
(2)实验中用托盘天平实际称取NaOH固体的质量是______.
(3)上述实验操作步骤缺少一步,请补充所缺步骤的位置及内容:______.
(4)在实验中,未进行操作④,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会______.称量时已观察到NaOH吸水,所配溶液的浓度会______.
参考答案:(1)配制实验所需实验步骤有称量、溶解、移液、洗涤、定容以及摇匀等操作,称量药品用托盘天平,加入到烧杯中溶解并用玻璃棒搅拌,冷却后用玻璃棒引流将液体转移到500ml容量瓶中,当溶液体积距离刻度线1~2cm时改用胶头滴管定容,故答案为:玻璃棒、胶头滴管;
(2)500mL?0.1mol/L的NaOH溶液中,NaOH的物质的量为:0.5L×0.1mol/L=0.05mol,
质量为:0.05mol×40g/mol=2.0g,故答案为:2.0g;
(3)配制实验所需实验步骤有称量、溶解、移液、洗涤、定容以及摇匀等操作,故答案为:②步后,溶液冷却后将其沿玻璃棒转移至容量瓶中;
(4)在实验中,未进行操作④,会导致溶液体积偏小,溶液浓度偏高;
定容时俯视液面,所配溶液的,会使溶液体积偏小,溶液浓度偏高;
称量时已观察到NaOH吸水,会导致溶质的质量偏小,溶液溶质的物质的量偏小,溶液浓度偏低,
故答案为:偏高;偏高;偏低.
本题解析:
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是( )
A.一定条件下4.6 g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
B.50 mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA
C.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA
D.电解1 L NaCl溶液至c(OH-)="0.2" mol/L,转移电子数为0.4NA
参考答案:A
本题解析:一定条件下4.6 g Na完全与O2反应,不论产物是什么,均有Na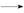 Na+~e-,故4.6 g Na(即0.2 mol Na)反应失去电子数为0.2NA,A项正确;根据反应:Cu+2H2SO4(浓)
Na+~e-,故4.6 g Na(即0.2 mol Na)反应失去电子数为0.2NA,A项正确;根据反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O可求得n(SO4)=
CuSO4+SO2↑+2H2O可求得n(SO4)= ×0.05×18.4 mol="0.46" mol,但随着反应的进行,浓H2SO4变稀则不再反应,故实际生成的SO2的分子数小于0.46NA,B项错误;合成氨为可逆反应,故转移电子数小于0.6NA,C项错误;即使电解前后溶液的体积不变,据反应2NaCl+2H2O
×0.05×18.4 mol="0.46" mol,但随着反应的进行,浓H2SO4变稀则不再反应,故实际生成的SO2的分子数小于0.46NA,B项错误;合成氨为可逆反应,故转移电子数小于0.6NA,C项错误;即使电解前后溶液的体积不变,据反应2NaCl+2H2O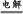 2NaOH+Cl2↑+H2↑~2 e-可求得转移的电子的物质的量为0.2 mol,故转移电子数为0.2NA,D项错误。
2NaOH+Cl2↑+H2↑~2 e-可求得转移的电子的物质的量为0.2 mol,故转移电子数为0.2NA,D项错误。
本题难度:一般
4、选择题 NA为阿伏加德罗常数,下列说法中正确的是(? )
A.17 g 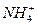 中含有的电子数为10NA
中含有的电子数为10NA
B.1 mol·L-1 Mg(NO3)2溶液中含有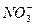 的数目为2NA
的数目为2NA
C.标准状况下,22.4 L甲苯所含的分子数为NA
D.室温下,28.0 g乙烯和丙烯中混合气体中含有的碳原子数为2NA
参考答案:D
本题解析:本题考查物质之间的包含关系,18 g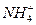 中含有的电子数才为10NA;B项没有溶液体积,无法求物质的量,所以无法求数目;C项甲苯为液体,不是气体,所以22.4 L甲苯并不是1 mol;乙烯和丙烯中原子个数C∶H=1∶2,所以不受乙烯和丙烯比例影响,只要质量一定,28.0 g中,含有的碳原子数为2NA。
中含有的电子数才为10NA;B项没有溶液体积,无法求物质的量,所以无法求数目;C项甲苯为液体,不是气体,所以22.4 L甲苯并不是1 mol;乙烯和丙烯中原子个数C∶H=1∶2,所以不受乙烯和丙烯比例影响,只要质量一定,28.0 g中,含有的碳原子数为2NA。
本题难度:简单
5、选择题 从1L1mol/LNaOH溶液中取出100ml,下列关于这100ml溶液的叙述中错误的是
A.含NaOH0.1mol
B.浓度为1mol/L
C.含NaOH4g
D.浓度为0.1mol/L