微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以氧化铝为原料制取氢氧化铝,最好的方法是
[? ]
A.将氧化铝溶于水
B.将氧化铝先溶于盐酸中,之后滴加氨水
C.将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液
D.将氧化铝溶于氢氧化钾
参考答案:B
本题解析:
本题难度:简单
2、填空题 (9分)镁是一种轻金属,其合金强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得”国防金属”的美誉。海水矿物质中镁的浓度仅次于氯和钠,居第三位。由于对镁的需求非常巨大,很多沿海国家都建有大型海水提镁工厂。
下表是有关物质的K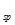 : ?
: ?
回答下列问题:
(1)能否直接把贝壳研磨成粉末,撒入海水中使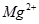 转化为
转化为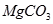 沉淀,并解释原因:?。
沉淀,并解释原因:?。
(2)实际生产中是把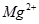 转化为
转化为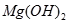 沉淀,而不是转化为
沉淀,而不是转化为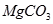 沉淀,其理由是?;请你推测应将贝壳进行怎样的加工处理?。
沉淀,其理由是?;请你推测应将贝壳进行怎样的加工处理?。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他?(填”能”或”不能”)将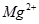 转化为
转化为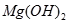 沉淀,理由是?。
沉淀,理由是?。
参考答案:(1)不能;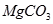 的溶解度比
的溶解度比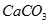 溶解度大,直接加贝壳粉末得不到
溶解度大,直接加贝壳粉末得不到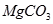 沉淀(2分)
沉淀(2分)
(2)为使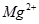 沉淀完全,应将
沉淀完全,应将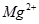 转化为溶解度更小的
转化为溶解度更小的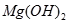 ?;(2分)研磨、煅烧、加水制成石灰乳。(2分)
?;(2分)研磨、煅烧、加水制成石灰乳。(2分)
(3)能;(1分)烧碱电离产生的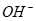 能结合
能结合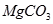 溶解产生的
溶解产生的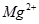 生成溶解度更小的
生成溶解度更小的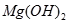 沉淀,使?
沉淀,使?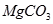 ?的沉淀溶解平衡不断向右移动。(2分)
?的沉淀溶解平衡不断向右移动。(2分)
本题解析:
(1)因为Ksp(CaCO3)<?Ksp(MgCO3)即2.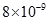 <?6.
<?6.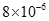 ,
,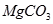 的溶解度比
的溶解度比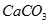 溶解度大,直接加贝壳粉末得不到
溶解度大,直接加贝壳粉末得不到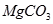 沉淀.
沉淀.
(2)为使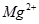 沉淀完全,应将
沉淀完全,应将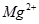 转化为溶解度更小的
转化为溶解度更小的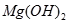 ?;(2分)应将贝壳研磨、煅烧、加水制成石灰乳。CaCO3=CaO+CO2↑? CaO+H2O="Ca" (OH)2? Mg2++2OH―="Mg" (OH)2↓
?;(2分)应将贝壳研磨、煅烧、加水制成石灰乳。CaCO3=CaO+CO2↑? CaO+H2O="Ca" (OH)2? Mg2++2OH―="Mg" (OH)2↓
(3) Mg2++CO32―=MgCO3? MgCO3+2OH―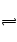 Mg(OH)2+CO32― ,烧碱电离产生的
Mg(OH)2+CO32― ,烧碱电离产生的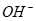 能结合
能结合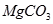 溶解产生的
溶解产生的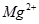 生成溶解度更小的
生成溶解度更小的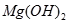 沉淀,使?
沉淀,使?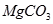 ?的沉淀溶解平衡不断向右移动。
?的沉淀溶解平衡不断向右移动。
本题难度:一般
3、填空题 镁是一种活泼性较强的金属,它不仅能在氧气、氮气中燃烧,还可以在二氧化碳中燃烧.请你写出这三个化学方程式,______;______;______;
请指出在这三个燃烧反应中的氧化剂分别是______、______、______;与二氧化碳的反应类似,镁也能在二氧化硫中燃烧,并试写出该反应的化学方程式:______.
参考答案:镁在氧气中燃烧生成氧化镁,方程式为2Mg+O2点燃.2MgO,在氮气中燃烧生成氮化镁,反应的方程式为3Mg+N2点燃.Mg3N2,在二氧化碳中燃烧生成氧化镁和碳,反应的方程式为,反应的氧化剂分别为氧气、氮气和二氧化碳,与二氧化碳的反应类似,镁也能在二氧化硫中燃烧,则应生成氧化镁和硫,反应的方程式为2Mg+SO2点燃.2MgO+S,
故答案为:2Mg+O2点燃.2MgO;3Mg+N2点燃.Mg3N2;2Mg+CO2点燃.2MgO+C;O2;N2;CO2;2Mg+SO2点燃.2MgO+S.
本题解析:
本题难度:一般
4、选择题 类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是
?
| 化学事实
| 类推结论
|
A
| pH=3的盐酸稀释1000倍后pH=6
| pH=6的盐酸稀释1000倍后pH=9
|
B
| 用电解熔融MgCl2的方法冶炼金属镁
| 用电解熔融NaCl的方法冶炼金属钠
|
C
| 将SO2通入BaCl2溶液中无沉淀生成
| 将SO2通入Ba(NO3)2溶液中也无沉淀生成
|
D
| Al在O2中燃烧生成Al2O3
| Fe在O2中燃烧生成Fe2O3
参考答案:B
本题解析:A、考虑水的电离,pH=6的盐酸稀释1000倍后pH接近7,错误;B、用电解熔融MgCl2的方法冶炼金属镁类推用电解熔融NaCl的方法冶炼金属钠,正确;C、将SO2通入Ba(NO3)2溶液中因发生氧化还原反应而生成硫酸钡沉淀,错误;D、Fe在O2中燃烧生成Fe3O4,错误。
本题难度:一般
5、实验题 (7分)某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·L-1 NaOH溶液。
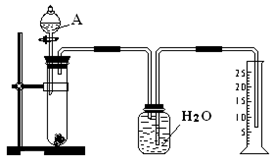
请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_______________________________(填字母)。
(2)A溶液可选用___________________________________________
(3)写出实验中发生反应的化学方程式:_________________________________________。
(4)若实验中测得样品的质量为Wg ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_?__。
参考答案:(1)c a b d (1分)
(2)6 mol·L-1NaOH溶液(2分)
(3)2Al + 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑?(2分)
(4)9a/11.2W × 100% (2分)
本题解析:(1)正确的操作顺序为c a b d;
(2)A溶液可选用:6 mol·L-1NaOH溶液,利用铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,而镁不能与氢氧化钠溶液反应;
(3)实验中发生反应的化学方程式为:2Al + 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑;
(4)由方程式2Al + 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑可得生成a L(标准状况)下氢气,需AL的质量为: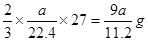 ;得样品中Al的质量分数为9a/11.2W × 100% ;得样品中Al的质量分数为9a/11.2W × 100%
本题难度:简单
|