微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,反应2CH3OH(g)  ?CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
?CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/(mol·L-1)
| 0.44
| 0.6
| 0.6
|
A.CH3OH的起始浓度为1.04 mol/L? B.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率 ?D.平衡时CH3OH的转化率小于80%
2、填空题 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性碳催化下合成。
(1)实验室中常用来制备氯气的化学方程式为_________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(△H)分别为-890.3kJ·mol-1、-285.8?kJ·mol-1和-283.0?kJ·mol-1,则生成1?m3
(标准状况)CO所需热量为___________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为___________;
(4)COCl2的分解反应为COCl2(g)=?Cl2(g)+?CO(g)?△H=+108?kJ·mol-1。反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
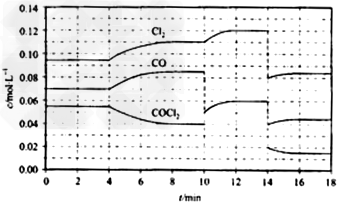
①来源:91 考试网计算反应在地8min时的平衡常数K=________;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)___?T(8)(填“<”、“>”或“=”?);
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率[平均反应速率分别以v(2-3)、v(5-6)、v(12-13)表示]的大小________;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)___?v(15-16)(填“<”、“>”或“=”),原因是_______
3、填空题 (12分)数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 。
(3)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。
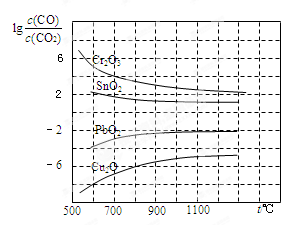
下列说法正确的是 。
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
(4)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
H++A2-。已知相同浓度时的电离程度H2A>HA-,设有下列四种溶液:
A.0.01mol/L的H2A溶液;
B.0.01mol/L的NaHA溶液;
C.0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液;
D.0.02mol/L的NaOH与0.02 mol/L的NaHA溶液等体积混合液。
据此,填写下列空白(填代号)
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
4、选择题 一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到限度的标志是( )
A.单位时间内生成3nmolX,同时消耗nmolY
B.X的生成速率与Z的生成速率相等
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数比为3:1:2
5、选择题 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)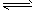 zC(g)平衡时测得A的浓度为
zC(g)平衡时测得A的浓度为
0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A 的浓度变为0.35mol/L,下列有关判断正确的是
[? ]
A.x+y<z
B.平衡正向移动
C.A的转化率降低
D.C的体积分数下降