微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定量的铁铝合金与300 mL 2 mol/L HNO3完全反应生成3.36 L NO(S·T·P)和三价铁盐、铝盐等,再向反应后的溶液中加入3 mol/L NaOH溶液,使铁、铝元素完全沉淀下来,则所加入溶液的体积是(?)
A.150 mL
B.200 mL
C.450 mL
D.无法计算
参考答案:A
本题解析:
硝酸的物质的量为:0.3L×2mol·L-1=0.6mol,生成NO的物质的量为: 3.36L/22.4L·mol-1=0.15mol,所以反应后溶液中NO3-离子的物质的量为0.6mol-0.15mol=0.45mol,再向反应后的溶液中加入 3mol·L-1的NaOH 溶液,使铝镁铁元素恰好全部转化为沉淀,则反应后溶液的成分为NaNO3,所以n(NaOH)=n(NO3-)=0.45mol,则所加 NaOH 溶液的体积是V=n/c=0.45mol/3mol·L-1=0.15L,即150ml.
选A.
本题难度:一般
2、计算题 回答如下几个问题
(1)近期发现不需要外加能源、节约水源而能除去废水中的卤代烷(有碍于人类健康)的方法:把铁放在含卤代烷的废水中,经一段时间后卤代烷“消失”。例如废水中的一氯乙烷经14.9d后就检不出来了。目前认为反应中卤代烷(RCH2X)是氧化剂。写出反应式并说明(按原子)得失电子的关系。
(2) 电解NaCl—KCl—AlCl3熔体制铝比电解Al2O3—Na3AlF6制铝节省电能约30%。为什么现仍用后一种方法制铝?
(3) NH4NO3热分解及和燃料油[以(CH2)n表示]反应的方程式及反应热分别为:
NH4NO3 = N2O + 2H2O + 0.53 kJ/g NH4NO3?…………(1)
NH4NO3 = N2 + 1/2 O2 + 2H2O + 1.47 kJ/g NH4NO3?………(2)
3n NH4NO3 + (CH2)n =" 3n" N2 + 7n H2O + n CO2
+ 4.29n kJ/g NH4NO3 ……(3)
试问:由以上三个热化学方程式可得出哪些新的热化学方程式?
(4) 参照水溶液化学反应的知识回答下面的问题:在液态BrF3中用KBrF4滴定Br2PbF10,过程中出现电导最低点。写出有关反应式。
参考答案:[解(1)] Fe+RCH2X+H+=Fe2++RH3+X—? (2分)
反应中1mol Fe失2mol电子,C得2mol电子。? (1分)
[解(2)]?主要是生产物无水AlCl3困难。制无水AlCl3的方法(反应式)
(1) ?2Al+3Cl2=2AlCl3
(2) ?Al2O3+3C+3Cl2=2AlCl3+3CO
若据(1)法制无水AlCl3,无意义(因用Al制成AlCl3再电解制Al)。
(2)法需Cl2,而制Cl2需电能。? (本小题总共4分)
[解(3)]? (2)式-(1)式? N2O = N2+ 1/2O2+0.94 kJ/g NH4NO3?
或41.4 kJ/mol? (2分)
这个热反应方程式是N2O分解热
(3)式-(2)式? (CH2)n + 3/2O2 = n CO2 + nH2O + 2.82 n kJ/moL
或676.8 n kJ/mol
这个热反应方程式是 (CH2)n的燃烧热。? (2分)
[解(4)]? 2KBrF4+(BrF2)2PbF6 = K2PbF6 + 4BrF3
(注:2BrF3 = BrF2+ + BrF4–?故KBrF4相当于水溶液体系中的KOH
(BrF2)2PbF6相当于水体系中的质子酸)? (4分)
本题解析:[试题分析与解题思路(1)]本题由四个小题组成,因而得分点较多。第一小题题面明确提到卤代烷可以跟金属铁起反应,反应中卤代烷是氧化剂,没有说的是卤代烷变什么和铁变什么。由于该反应对学生是很陌生的,是无机与有机的结合点,看似简单实在不易。但在实际面对铁与卤代烃的反应方程式时,猜出卤代烃被还原是生成烃而铁被氧化是生成二价铁是不难的。氢原子不足了,因而反应物里应添氢离子(质子)。这个试题猜测的成分较高,信息量过少。卤代烃被还原究竟得到什么烃?答案给出的是最简单的情况。写其他烃也不能说就答错了。但无论如何卤代烃里的氯反应后应当变成氯离子而不会是氯气之类,否则有悖题意(卤代烃被还原)。
[解(1)] Fe+RCH2X+H+=Fe2++RH3+X—? (2分)
反应中1mol Fe失2mol电子,C得2mol电子。? (1分)
[评注] 应试结果此题得分率很高。区分度不大。
[试题分析与解题思路(2)]学生在解第二小题时可能会觉得不知题面给的信息意味着什么而束手无策。这是在考察学生的实际观念。如果想到用AlCl3电解制铝省电而不用,可能是因为制备AlCl3仍然要用电,就上了正道。制备一种有用的化学品必定要考虑原料来源,这是制备反应的一般原则。
[解(2)]?主要是生产物无水AlCl3困难。制无水AlCl3的方法(反应式)
(3) ?2Al+3Cl2=2AlCl3
(4) ?Al2O3+3C+3Cl2=2AlCl3+3CO
若据(1)法制无水AlCl3,无意义(因用Al制成AlCl3再电解制Al)。
(3)法需Cl2,而制Cl2需电能。? (本小题总共4分)
[注]此题的应答可能与标准答案的表述不同,但只要说到点子上都可得分。
[评注] 应答结果,大多数学生答不出来。因为学生没有从原料的来源上考虑问题。这就是说,命题人的测试切中要害,我们现在的中学教学在联系实际的理解上可能有些问题。
[试题分析与解题思路(3)]第三小题需要反复思考题面给出的三个反应的可能组合才会找到答案。这个试题是热化学定律的灵活运用。思考容量大,但最后得到的结果是唯一的。
[解(3)]? (2)式-(1)式? N2O = N2+ 1/2O2+0.94 kJ/g NH4NO3?
或41.4 kJ/mol? (2分)
这个热反应方程式是N2O分解热
(4)式-(2)式? (CH2)n + 3/2O2 = n CO2 + nH2O + 2.82 n kJ/moL
或676.8 n kJ/mol
这个热反应方程式是 (CH2)n的燃烧热。? (2分)
[试题分析与解题思路(4)]第四小题的信息分析是很难的,只有想象力丰富的学生才可能答得上来。如果学生想到滴定反应电导降低意味着产物的离子总数比反应物离子总数少,就应将水溶液的中和反应迁移到这种以BrF3为溶剂的新情景中来,想到这个滴定反应一定是生成了溶剂分子,于是就会想到题面给出的Br2PbF10可以看成是BrF2+与PbF62–的结合物,这样,问题就得解了。
[解(4)]? 2KBrF4+(BrF2)2PbF6 = K2PbF6 + 4BrF3
(注:2BrF3 = BrF2+ + BrF4–?故KBrF4相当于水溶液体系中的KOH
(BrF2)2PbF6相当于水体系中的质子酸)? (4分)
[评注] 此小题应答结果表明,这样生疏的命题大多数学生不知道从哪里想起,答不上来。
本题难度:一般
3、选择题 下列物质中,既能与盐酸反应又能与NaOH溶液反应的是(?)
①Al?②(NH4)2CO3?③AlCl3?④NaAlO2?⑤Al2O3?⑥NaHCO3
A.①②③⑤
B.①③⑤⑥
C.①②⑤⑥
D.全部
参考答案:C
本题解析:①Al既能跟NaOH溶液反应,又能跟盐酸反应,故①正确;②(NH4)2 CO3溶液属于弱酸的铵盐溶液,既能跟NaOH溶液反应,又能跟盐酸,故②正确; ③AlCl3溶液只能与碱不反应,不与酸反应,故③错误;④NaAlO2溶液只能与酸不反应,不与碱反应,故④错误;⑤Al2O3既能跟NaOH溶液反应,又能跟盐酸反应,故⑤正确; ⑥NaHCO3溶液能与酸反应生成二氧化碳气体,与碱反应生成碳酸钠,故⑥正确,选C。
本题难度:一般
4、选择题 金属铝既可与强酸溶液反应,又可与强碱溶液反应.当金属铝和适量的NaOH溶液恰好完全反应时,下列说法合理的是
A.该反应中的氧化剂有两种,而还原产物只有一种
B.1mol铝完全反应生成33.6L氢气
C.所得溶液蒸干并灼烧会生成氧化铝
D.54?g铝完全反应,水得到的电子数为6NA
参考答案:D
本题解析:分析:A、铝碱溶液反应的本质,是铝与水反应生成氢氧化铝与氢气,氢氧化铝再与氢氧化钠反应,生成偏铝酸盐;
B、氢气所处的状态不一定是标准状况;
C、偏铝酸钠水解呈碱性,生成的氢氧化钠与氢氧化铝反应生成偏铝酸钠;
D、根据n=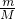 计算铝的质量,反应中水是氧化剂,Al是还原剂,Al元素化合价由0价升高为+3价,据此计算转移电子数目.
计算铝的质量,反应中水是氧化剂,Al是还原剂,Al元素化合价由0价升高为+3价,据此计算转移电子数目.
解答:A、铝碱溶液反应的本质,是铝与水反应生成氢氧化铝与氢气,氢氧化铝再与氢氧化钠反应,生成偏铝酸盐,反应中Al是还原剂,水是氧化剂,还原产物是氢气,氧化剂有1种,还原产物有1种,故A错误;
B、1molAl反应转移3mol电子,生成1.5mol氢气,若氢气为标准化状况,体积为33.6L,但氢气所处的状态不一定是标准状况,故B错误;
C、偏铝酸钠水解呈碱性,生成的氢氧化钠与氢氧化铝反应生成偏铝酸钠,故蒸干偏铝酸钠溶液,获得的固体为偏铝酸钠,故C错误;
D、54g铝的物质的量为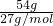 =2mol,反应中水是氧化剂,Al是还原剂,Al元素化合价由0价升高为+3价,故Z转移电子数目为2mol×3×NAmol-1=6NA,故D正确;
=2mol,反应中水是氧化剂,Al是还原剂,Al元素化合价由0价升高为+3价,故Z转移电子数目为2mol×3×NAmol-1=6NA,故D正确;
故选D.
点评:本题考查铝的性质、盐类水解、氧化还原反应及计算等,难度不大,注意A选项为易错点,理解铝与碱溶液反应的本质.
本题难度:一般
5、选择题 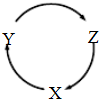 下表各组物质中,能满足右图所示一步转化关系的是?
下表各组物质中,能满足右图所示一步转化关系的是?
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.NaHCO3不能直接转化为Na;
B.CuO不能直接生成Cu(OH)2,且Cu(OH)2不能直接生成Cu;
C.可直接转化生成;
D.转化关系中二氧化硅不能一步转化为硅酸.
解答:A.NaHCO3不能直接转化为Na,用通过电解NaCl法制备,故A错误;
B.CuO不能直接生成Cu(OH)2,且Cu(OH)2不能直接生成Cu,故B错误;
C.发生C CO
CO CO2
CO2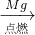 C,可实现,故C正确;
C,可实现,故C正确;
D.(SiO2)→(H2SiO3)一步不能转化,故D错误.
故选C.
点评:本题考查考生对常见元素及其化合物知识的掌握情况,可用代入法,即把各选项中的X、Y、Z代入右图的圆圈中进行判断,题目难度不大.
本题难度:简单