微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下面关于多电子原子核外电子的运动规律的叙述正确的是(?)。
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.不同能量的电子在核外运动占有的区域形状可能不同
参考答案:AD
本题解析:根据玻尔理论可直接判断B、C二项不正确;D项叙述“可能不同”是正确的,如2px与4py电子运动占有的区域形状相同,但它们的能量不同,1s与2p电子能量不同,运动占有的区域形状也不同。
本题难度:简单
2、选择题 下列说法正确的是(? )
A.在物质的量均为1mol的LiH、LiD、LiT三种物质中,质子数之比为4∶5∶6
B.Ca2+、K+、Cl-、S2-四种离子的半径依次减小
C.在原子中,质量数一定大于质子数
D.一个乙烷分子中存在7对共用电子
参考答案:D
本题解析:略
本题难度:简单
3、选择题 镭是元素周期表中第7周期第ⅡA族元素,关于其叙述不正确的是( )。
A.镭的金属性比钙弱
B.单质能与水反应生成H2
C.镭在化合物中呈+2价
D.碳酸镭难溶于水
参考答案:A
本题解析:镭是第ⅡA族元素,自上至下,元素的金属性增强,故比钙还活泼,与水反应生成氢气,A错误,B正确;最外层有2个电子,在化合物中呈+2价,类比碳酸钙难溶于水,碳酸镭也难溶于水,C、D正确。
本题难度:一般
4、填空题 元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
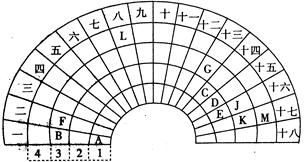
(1)元素C的最高价氧化物的电子式为?;元素G的离子结构示意图为?。
(2)元素L位于周期表的第?族, 1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_______性,原因是___________
_____________________________________________________(用离子方程式表示)
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的则该反应的化学方程式为?。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________
参考答案:(1)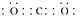 ?
?
(2)VIII? 10Fe2++6Br - +8Cl2=10Fe3++3Br2+16Cl-
(3)碱性,(1分) AlO2-+2H2O  Al(OH)3+OH-
Al(OH)3+OH-
(4)Al2O3+3C+N2  2AlN+3CO
2AlN+3CO
(5)? SiO+2NaOH=Na2SiO3+H2↑
本题解析:根据元素周期表中元素的相对位置,推A为氢、B为钠、C为碳、D为氮、E为氧、F为镁、G为铝、J为硫、K为氯、L为铁、M为溴。
(1)元素C的最高价氧化物为二氧化碳,电子式为 。元素G为铝,Al3+的离子结构示意图为
。元素G为铝,Al3+的离子结构示意图为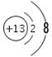 。
。
(1) ?
?
(2)元素L为铁,位于周期表的第VIII族? 1mol·L-1 LM2(FeBr2)溶液500mL与0.4 mol K单质(Cl2)的物质的量之比为5:4,恰好完全反应,因为还原性:Fe2+> Br-,因此Fe2+先被氧化:2Fe2++ Cl2 ?Fe3+ + 2Cl-,
?Fe3+ + 2Cl-,
每摩尔Fe2+反应用掉0.5molCl2,即按4:2反应,还剩余1.5mol的Cl2与Br-反应:2Br-+ Cl2 ?Br2 + 2Cl-,
?Br2 + 2Cl-,
注意只有3mol的Br-被Cl2氧化了,因为Cl2不足,整理得总反应:10Fe2+ +8Cl2+6Br- 10Fe3+ +16Cl- +3Br2。
10Fe3+ +16Cl- +3Br2。
(3)化合物X是NaAlO2,属于强碱弱酸盐, 水解显碱性,AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
(4)化合物GD是AlN,G的氧化物是Al2O3,C单质是,D单质是氮气,Al2O3与C物质的量之比为1:3,用待定系数法。先假设Al2O3系数为1,C为3,可知AlN为2,N2为1,根据原子守恒,推知还生成3molCO,最后整理得Al2O3+3C+N2  2AlN+3CO。
2AlN+3CO。
(5)SiO和NaOH溶液反应,因为产物之一是酸钠,硅化合价由+2变为+4,化合价有升高,必然有化合价降低,分析可知,只有氢元素化合价可以降低,推出另一产物是氢气,配平得SiO+2NaOH=Na2SiO3+H2↑。
本题难度:一般
5、选择题 中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱
D.若M+和R2-的核外电子层结构相同,则可推出原子序数:R>M
参考答案:A
本题解析:A正确,B中卤族元素中氟只有负价没有正价;C中只能推出氢化物的稳定性从上到下在降低;D中原子序数应该是M>R。
点评:本题每个选项都在考查元素周期律,但是规律应用的同时也有很多特殊的元素,例如氟只有负价。每条规律都有适用的条件,例如氢化物无法判断酸性强弱,却能比较稳定性。
本题难度:一般