微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:CH3CH2CH2CH3(g)+6.5 O2(g)===4CO2(g)+5H2O(l);ΔH=-2 878 kJ/mol (CH3)2CHCH3(g)+6.5
O2(g)===4CO2(g)+5H2O(l);ΔH=-2 869 kJ/mol 下列说法正确的是
[? ]
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
参考答案:A
本题解析:
本题难度:一般
2、填空题 (6分)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g)
参考答案:
本题解析:
本题难度:一般
3、填空题 X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素
| 相关信息
|
X
| X的基态原子核外3个能级上有电子,且每个能级上的电子数相等
|
Y
| 双原子分子单质在标准状况下密度为1.429g/L
|
Z
| 单质及其化合物的焰色反应为黄色
|
W
| W元素基态原子的M层全充满,N层只有一个电子
|
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
(2)X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的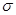 键和
键和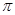 键的个数比是 。
键的个数比是 。
(3)Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4(aq) ="=" ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) ="=" 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
③H2(g)+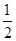 O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示): 。
参考答案:(14分)
(1)二 IV A (分) 原子(每空1分)
(2)O (1分) 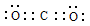 (2分) 1:1(1分)
(2分) 1:1(1分)
(3)离子键、非极性键(或共价键) (2分) [Ar]3d104s1 (2分)
(4)Cu (s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O (l) ?H =" -" 319.6 kJ / mol (3分)
本题解析:X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则X的核外电子排布是1s22s22p2,所以X是C元素;Y的双原子分子单质在标准状况下密度为1.429g/L,则相对分子质量是1.429×22.4=32,所以Y的相对原子质量是16,则Y是O元素;焰色反应为黄色的元素为Na,则Z是Na元素;W元素基态原子的M层全充满,N层只有一个电子,则W的电子层排布是2、8、18、1,所以W为Cu元素。
(1)C元素位于元素周期表的第二周期IVA族;C元素组成的单质中,金刚石熔点很高,硬度很大,属于原子晶体;
(2)C与O元素中电负性较强的是O;二氧化碳是共价化合物,C与O原子之间形成2对共用电子对,所以电子式是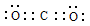 ;C=O中有1个
;C=O中有1个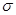 键和1个
键和1个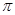 键,所以
键,所以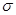 键和
键和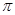 键的个数比是1:1;
键的个数比是1:1;
(3)过氧化钠属于离子化合物,含有离子键,且O与O原子之间是共价键,所以过氧化钠中既含离子键又含共价键;Cu的基态原子的核外电子排布式是[Ar]3d104s1;
(4)A是Cu单质,根据盖斯定律,将氧气与氢气消去,①+③+②/2,可得所求热化学方程式,所以A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式为Cu (s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O (l)?H =(64.4-285.8)kJ/mol-196.4/2kJ/mol="-" 319.6 kJ / mol。
考点:考查元素的推断,盖斯定律的应用,化学用语的书写
本题难度:困难
4、简答题 CH4?是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ?mol-1.它可以作为燃料电池的燃料.
(1)写出甲烷燃烧的热化学方程式:______;
(2)已知H2(g)和C(s)的燃烧热分别是285.8KJ?mol-1、393.5KJ?mol-1;则反应C(s)+2H2(g)=CH4(g)的反应热△H=______;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池.该电池的负极反应式为:______;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500ml滴有酚酞的NaCl溶液,装置如图所示:
①请写出电解过程中阴极附近观察到的现象:______.
②到燃料电池消耗2.8L?O2(标准状况下)时,计算此时NaCl溶液的pH=______(假设溶液的体积不变,气体全部从溶液中逸出).在Y极通过的电子的物质的量为:______.
③电解之后,要使溶液恢复原状,应该向溶液中加入物质______(填名称).溶液中Cl-流向______极(填“X”或“Y”).
参考答案:(1)CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ?mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(2)25℃、101kPa下,H2(g)、C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;
则①H2(g)+12O2(g)=H2O(l)△H=-285.8kJ?mol-1;
②C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1;
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol;
依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8KJ/mol;
故答案为:-74.8KJ/mol;
(3)负极上的电极反应式等于电池的总反应式-正极发生的电极方程式;以甲烷、空气、氢氧化钾溶液为原料,惰性电极可构成燃料电池,正极反应为:3O2+12H2O+12e-=12OH-,总反应式为:CH4+2O2+2OH-=CO32-+3H2O,两式相减,负极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(4)燃料电池为电源,以石墨为电极电解500ml滴有酚酞的NaCl溶液,X为电解池的阳极,Y为电解池的阴极;
①阴极是溶液中的氢离子得到电子生成氢气,溶液中水的电离被破坏,生成了氢氧根离子显碱性,遇酚酞变红;电解过程中阴极附近观察到的现象是,阴极附近变红;
故答案为:阴极附近变红;
②甲烷燃料电池的正极消耗氧气,燃料电池消耗2.8L O2物质的量=2.8L22.4L/mol=0.125mol;正极反应为:3O2+12H2O+12e-=12OH-,计算得到电子转移为0.5mol;电解氯化钠溶液阴极电极反应为:2H++2e-=H2↑,根据水电离出的氢氧根离子和氢离子守恒,溶液中减少的氢离子和增加的氢氧根离子相同,计算得到生成氢氧根离子物质的量为0.5mol,C(OH-)=0.5mol0.5L=1mol/L;所以溶液PH=14;电极上的电子守恒得到在Y极通过的电子的物质的量为0.5mol;
故答案为:14; 0.5mol;
③电解氯化钠溶液生成了氢气、氯气和氢氧化钠,恢复原溶液浓度需要加入氢气和氯气组成的含氯化氢的盐酸溶液;电解过程中阴离子移向阳极;故答案为:盐酸;阳.
本题解析:
本题难度:一般
5、填空题 按要求写热化学方程式:
(1)已知稀溶液中,1mol?H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式______.
(2)25℃、101kPa条件下充分燃烧一定量的丁烷气体放出热量为Q?kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热化学方程式______.
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+
O2(g)═H2O(l)△H3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式______.
参考答案:(1)中和热是指强酸、强碱生成1mol水放出的热量,1mol?H2SO4与NaOH溶液恰好完全反应时,生成2mol水,放出114.6kJ热量,则生成1mol水时放出57.3kJ的热量,
所以H2SO4与NaOH反应的中和热化学方程式为:
12H2SO4(aq)+NaOH(aq)=12Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:12H2SO4(aq)+NaOH(aq)=12Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
(2)n(CaCO3)=25g100g/mol=0.25mol,
Ca(OH)2+CO2=CaCO3+H2O ?
?1? 1
0.25mol?0.25mol?
即丁烷燃烧生成的二氧化碳为0.25mol.
2C4H10+13O2=8CO2+10H2O
2?8
?x? 0.25mol?
x=116mol?
因为燃烧116mol的丁烷放出的热量为Q,则丁烷的燃烧热为16Q,
所以表示丁烷燃烧热化学方程式为 C4H10(g)+132O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol,
故答案为:C4H10(g)+132O2(g)=4CO2(g)+5H2O(l)△H=-16QkJ/mol;
(3)已知:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+12O2(g)═H2O(l?)△H3=-285.8kJ/mol
利用盖斯定律将②×2+③×2-①可得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=-488.3kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=-488.3kJ/mol.
本题解析:
本题难度:一般