微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知2SO2(g)+O2(g)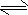 2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入
2molSO2、1molO2和1molSO3、1molSO2、0.5molO2,当它们分别达到平衡时放出的热量为Q1KJ和Q2KJ,则下列比较正确的是
[? ]
A.Q2= 1/2 Q1=98.5
B.Q2=1/2 Q1<98.5
C.Q2<1/2 Q1<98.5
D.1/2 Q1< Q2 <98.5
参考答案:C
本题解析:
本题难度:一般
2、计算题 合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L。若N2、H2起始时总物质的量为1mol,求该合成氨厂N2的转化率。
参考答案:设N2、H2起始时总物质的量为1mol,其中N2为x mol,H2为(1-x)mol,
28x+2(1-x)=0.5536×22.4
x=0.4mol
N2为0.4mol,H2为0.6mol
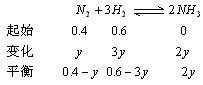
n总=0.4-y+0.6-3y+2y=(1-2y)mol
反应前后,气体总质量为一定值,则有
1×22.4×0.5536=(1-2y)×22.4×0.693
y=0.1mol
的转化率为
本题解析:
本题难度:一般
3、选择题 在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是?(? )
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为60%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
参考答案:C
本题解析:反应进行到2s时,NO2的浓度为0.02mol·L-1,所以前2s,NO2的平均反应速率为0.01mol·L-1·s-1。根据反应速率之比是相应的化学计量数之比可知,前2s,N2O4的平均反应速率为0.005mol·L-1·s-1,A正确。在2s时,容器内NO2的物质的量是0.1mol,消耗N2O40.05mol,在2s时,体系内压强为反应前的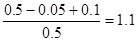 倍,D正确。
倍,D正确。
N2O4(g) 2NO2(g)
2NO2(g)
起始量(mol)? 0.5? 0
转化量(mol)? x? 2x
平衡量(mol)? 0.5-x? 2x
因此有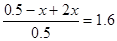 ,解得x=0.3。所以平衡时,N2O4的转化率为
,解得x=0.3。所以平衡时,N2O4的转化率为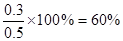 。平衡时体系内NO2为0.6mol,其浓度是0.12 mol·L-1。所以答案是C。
。平衡时体系内NO2为0.6mol,其浓度是0.12 mol·L-1。所以答案是C。
本题难度:一般
4、选择题 往一真空密闭容器中通入一定量的气体A,在一定温度下,发生如下反应:
2A(g)?B(g)+xC(g)反应达平衡时,测得容器内压强增大了p%,若此时A的转化率为a%,下列关系正确的是
①若x=1,则p>a?②若x=2,则p<a?③若x=3,则p=a?④若x=4,则p≥a( )
A.②③
B.①④
C.②③④
D.②④
参考答案:设开始时加入气体A的物质的量为1 mol,则由题意得?
? 2A(g)=B(g)+xC(g)?
起始量(mol):1? 0? 0
变化量(mol):a%?12?a%? x2?a%?
平衡量(mol):1-a%?12a%? x2?a%
?总:1-12a%+x2?a%
?由题意知:1-12a%+x2?a%=1+p%,解得,ax=a+2p
代入①②③④选项分析判断,
①若x=1,则p>a? ?ax=a+2p? p=0,压强不变,故①错误;
②若x=2,则p<a? p=0.5a? 则p<a,故②正确;
③若x=3,则p=a? ?p=a? ③故正确;
④若x=4,则p≥a? p=1.5a? 则p>a,故④错误;
综上所述:②③正确;
故选A.
本题解析:
本题难度:简单
5、选择题 在一个容积为6 L的密闭容器中,放入3 L X(g)和2 L Y(g),在一定条件下发生反应:
4X(g)+nY(g) 2Q(g)+6R(g)
2Q(g)+6R(g)
反应达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应中的n值为(?)
A.3
B.4
C.5
D.6
参考答案:A
本题解析:因X的浓度减小,说明反应向正反应方向进行,又因混合气体的压强比原来增加了5%,说明正反应为气体总体积扩大的反应,则有:4+n<2+6,所以n<4。
本题难度:简单