微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在体积为10L的密闭容器中,1mol?X和1mol?Y进行应:2X(g)+Y(g)?Z(g),经2min达到平衡,生成0.6mol?Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001?mol/(L?s)
B.将容器体积变为20?L,Z的平衡浓度为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
参考答案:A、经2min达到平衡,生成0.6molZ,则Z的反应速率v(Z)=0.6mol10L120s=0.0005mol/(L?s),根据化学反应速率之比等于化学质量数之比,由方程式可知,v(X)=2v(Z)=2×0.0005mol/(L?s)=0.00lmol/(L?s),故A正确;
B、反应前后气体的化学计量数之和不相等,体积变为20L,体系的压强减小,平衡向逆反应方向移动,Z的平衡浓度小于原来的12,故B错误;
C、增大压强平衡向正反应方向移动,反应物Y的转化率增大,故C错误;
D、升高温度,X的体积分数增大,说明升高温度平衡向逆反应方向移动,则正反应的△H<0,故D错误.
故选:A.
本题解析:
本题难度:简单
2、填空题 常温下,两种溶液① 0.1 mol?L-1 NH3·H2O?② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH ??7(填“>”、“<”或“=”),其原因是:?(用电离方程式表示)。
(2)溶液②呈?性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以?(填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是?(填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
参考答案:(1)>(1分)? NH3·H2O  ?NH4+ +OH- (2分)
?NH4+ +OH- (2分)
(2)酸(1分)?促进(1分)
(3)b (1分)
本题解析:
试题解析:(1)NH3·H2O是弱碱,其在水中部分电离产生NH4+、OH-,所以pH>7,
(2)NH4Cl溶液中的NH4+水解会使溶液呈酸性,pH<7,水解反应是吸热反应,升温使平衡向吸热反应方向进行,因此会促进NH4Cl的水解。
(3)a、NH3·H2O是弱碱,不完全电离;NH4Cl溶液中NH4+部分水解,所以两种溶液NH4+的浓度均小于0.1mol/l,错误;b、正确;c、两种溶液中NH4+的浓度的大小由电离程度和水解程度的强弱来判断,本题中无法判断,答案选b。
本题难度:简单
3、选择题 在一定温度下的密闭容器中,不能表明A(s)+2B(g) C(g)+D(g)已达平衡的是?
C(g)+D(g)已达平衡的是?
A.A的质量不再发生改变
B.气体的总物质的量不再发生改变
C.C的分子数不再发生改变
D.D的物质的量浓度不再发生改变
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项ACD都可以说明。反应前后气体的体积不变,因此气体的总物质的量始终是不变的,B不能说明,答案选B。
点评:该题是中等难度的试题,该题也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,如何结合具体的可逆反应灵活运用即可。
本题难度:简单
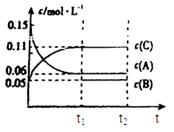
4、填空题 向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。
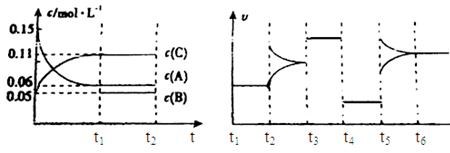
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)=?mol/(L?s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正?v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为?mol;
(4)t1时刻,平衡常数K=?;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式?;
(6)若t2时刻后图像变化如下图,则改变条件为?
 ?
?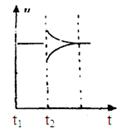
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
参考答案:(1)0.004(2)小于(3)0.04(4)2.80
(5)3A(g) B(g)+2C(g)?ΔH=+100a kJ?mol-1(6)bd
B(g)+2C(g)?ΔH=+100a kJ?mol-1(6)bd
本题解析:(1)若t1=15s,生成物C在t0~t1时间段的平均反应速率v=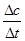 =
=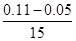 mol/(L?s)=0.004mol/(L?s);(2)由题意知,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
mol/(L?s)=0.004mol/(L?s);(2)由题意知,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g) B(g)+2C(g),若t2—t3阶段,C的体积分数变小,说明反应向逆反应方向进行,则v正<v逆;(3)根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),若t2—t3阶段,C的体积分数变小,说明反应向逆反应方向进行,则v正<v逆;(3)根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为 =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;(4)在t1时刻,c(A)=0.06 mol/L,c(B)=0.05 mol/L,c(C)=0.11 mol/L,故平衡常数K=
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;(4)在t1时刻,c(A)=0.06 mol/L,c(B)=0.05 mol/L,c(C)=0.11 mol/L,故平衡常数K= =
=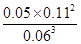 =2.80;(5)反应的方程式为3A(g)
=2.80;(5)反应的方程式为3A(g) B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g)
B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g) B(g)+2C(g),△H=+100akJ?mol-1;(6)恒温恒压下反应图像变化达到平衡,一种反应速率瞬间减小,一种瞬间增大,最后达到平衡,3A(g)
B(g)+2C(g),△H=+100akJ?mol-1;(6)恒温恒压下反应图像变化达到平衡,一种反应速率瞬间减小,一种瞬间增大,最后达到平衡,3A(g) B(g)+2C(g),则a不符,d符合,c不符,b符合
B(g)+2C(g),则a不符,d符合,c不符,b符合
本题难度:一般
5、选择题 已知反应2SO2(g)+O2(g) 2SO3(g),下列判断正确的是
2SO3(g),下列判断正确的是
A.2 mol SO2和足量O2反应,必定生成2 mol SO3
B.该反应在容积不变的密闭容器中,若混合气的密度不变,说明达到平衡状态
C.平衡时,SO2消耗速率必定等于O2生成速率的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
参考答案:C
本题解析:A错误,反应2SO2(g)+O2(g) 2SO3(g)为可逆反应,其转换率不可能达到百分之百,所以2 mol SO2和足量O2反应,必定生成小于2 mol的 SO3;B错误,容积不变,则在反应的任何一个时候,包括没有达到平衡都是混合气的密度不变;C正确,D错误,没有说明各物质的量,所以SO2浓度不一定等于O2浓度的两倍。故答案为C。
2SO3(g)为可逆反应,其转换率不可能达到百分之百,所以2 mol SO2和足量O2反应,必定生成小于2 mol的 SO3;B错误,容积不变,则在反应的任何一个时候,包括没有达到平衡都是混合气的密度不变;C正确,D错误,没有说明各物质的量,所以SO2浓度不一定等于O2浓度的两倍。故答案为C。
点评:本题考查了化学平衡的基础知识,是高考考查的热点,本题难度适中。
本题难度:一般