微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
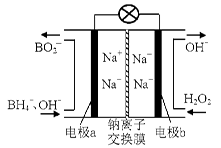
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为:?;
以MnO2做正极材料,可能是因为?。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g)?△H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g)?△H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g)??△H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H=?。
(3)O3?可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
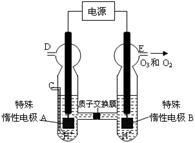
②?图中阴极为?(填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为:?。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为?(忽略?O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx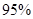 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是??
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是??

a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
参考答案:(14分)
⑴H2O2 + 2e—= 2OH—;除了作电极材料,MnO2还对电极反应具有催化作用
⑵-643.28kJ·mol—1?
⑶① A?② O2+4H++4e-=2H2O?③2︰1?
⑷cd?(每空2分,共14分)
本题解析:(1)原电池负极发生氧化反应,正极反应还原反应,由原电池工作原理图1可知,电极a为负极,电极b为正极,H2O2在正极放电生成OH-,电极反应式为H2O2+2e-=2OH-; MnO2对电极反应具有催化作用。
故答案为:H2O2+2e-=2OH-;MnO2对电极反应具有催化作用。
(2)已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1
②H2O2(l)=H2O(l)+1/2O2(g)△H=-98.64kJ?mol-1
③H2O(l)=H2O(g)△H=+44kJ?mol-1
由盖斯定律,①+②×2+③×3得N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-534kJ?mol-1+2×(-98.64kJ?mol-1)+2×44kJ?mol-1=-643.28kJ?mol-1
故答案为:-643.28kJ?mol-1。
(3)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极。
故答案为:A。
②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O.
故答案为:O2+4H++4e-=2H2O。
③若C处不通入O2,实质为电解水,D处为氢气,物质的量为11.2L/22.4(L/mol) =0.5mol,E处为氧气、臭氧,物质的量共为4.48L/22.4(L/mol)=0.2mol,令臭氧的物质的量为xmol,根据电子转移守恒有0.5mol×2=xmol×3×2+(0.2mol-xmol)×2×2,解得x=0.1,所以E处收集的气体中O3所占的体积分数为(0.1mol/0.2mol)×100%=50%。
故答案为:50%。
(4)该反应反应前后气体的物质的量不变,容器体积不变,故体系压强恒定.绝热恒容密闭容器,体系温度随反应进行变化,随反应进行反应物的浓度降低,由图可知,c点以前正反应速率增大,说明正反应为放热反应,c点以后反应正反应速率降低,应是浓度影响比温度影响更大.图为正反应速率随时间变化,说明反应未到达平衡。
a.反应在c点前,温度对速率影响大,c点以后浓度减小对速率影响大,C点未达到平衡状态,故a错误;
b.反应为达平衡,b点在c点之前,浓度反应物浓度:b点大于c点,故b错误;
c.该反应为放热反应,反应物的总能量高于生成物的总能量,故c正确;
d.a~b段反应速率小于b~c段反应速率,△t1=△t2时,b~c段反应的NO更多,故NO的转化率:a~b段小于b~c段,故d正确。
故选:cd。
点评:考查原电池与电解池反应原理、反应热的计算、氧化还原反应计算、化学平衡图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力。
本题难度:一般
2、选择题 有X、Y、Z、M四种金属.已知,X和Z可以从Y的盐溶液中置换出Y,利用X和Z制作原电池时,Z为正极,M的离子氧化性强于Y的离子.则这四种金属的活动性由强到弱的顺序为
A.X、Y、Z、M
B.X、Z、M、Y
C.M、Z、X、Y
D.X、Z、Y、M
参考答案:D
本题解析:讲析:X和Z可以从Y的盐溶液中置换出Y,说明金属活动性:X>Y、Z>Y,排除A选项.M离子的氧化性强于Y的离子,说明M金属活动性弱于Y,排除B、C选项.正确答案为D选项.
点评:根据原电池原理可以判断金属活动性(还原性)的强弱.在由两种不同的金属构成原电池的两极中,发生氧化反应的是负极,发生还原反应的是正极金属,一般情况下,金属活动性(还原性)强弱:负极>正极.
本题难度:一般
3、简答题 (17分)I.KNO3俗名硝石,是一种重要的化工原料,在农业上用途十分广泛,下面是一种KNO3制备方法的主要步骤:
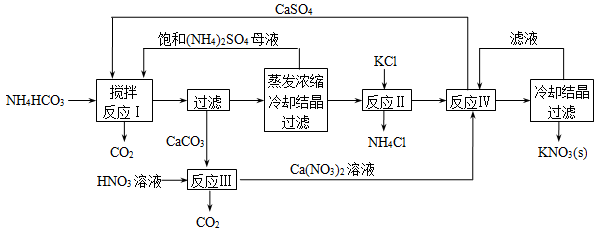
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1︰2,该反应的化学方程式为?。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是?;从反应Ⅳ所得混合物中分离出CaSO4的方法是?(填“趁热过滤”、“冷却过滤”)。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,?。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有?(填化学式)。
(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B。B是三原子分子,B与O2反应生成1体积黄绿色气体A和2体积红棕色气体C。B的分子式为?。
II.(1)工业上可采用电化学的方法获得N2H4,装置如右图所示,则通入氧气的 一极为?(填“正极”、“负极”),NH3反应的电极反应式为?。

(2)肼(N2H4)可以在纯氧中燃烧生成氮气和水,为了充分利用其能量,?有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式?。
参考答案:I.(每空2分)(1)CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑?
(2)分离NH4Cl与K2SO4,加快化学反应速率 ;?趁热过滤
(3)加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl
(4)CaSO4、KNO3
(5)NOCl
II.(1)正极(1分)2NH3—2e?+2OH?=N2H4+2H2O(2分)
(2)N2H4—4e?=N2+4H+(2分)
本题解析:I.(1)根据流程图可知反应物有CaSO4和NH4HCO3、生成物有CaCO3、(NH4)2SO4、CO2、H2O,配平可得化学方程式:CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑
(2)反应Ⅱ生成K2SO4和NH4Cl,所以在干态、加热的条件下进行,有利于分离NH4Cl与K2SO4,加快化学反应速率 ;KNO3的溶解度受温度影响大,温度低时小,为了防止KNO3结晶,提高KNO3的产率,应趁热过滤。
(3)要检验K2SO4中是否混有KCl,需要排除SO42?的干扰,所以正确方法为:取少量K2SO4样品溶解于水,加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl,反之,不含KCl。
(4)根据化学流程图,CaSO4、KNO3可循环使用。
(5)B是三原子分子,B与O2反应生成1体积气体A和2体积红棕色气体C,C应为NO2,黄绿色气体应为Cl2,则B中含有N元素和Cl元素,反应的方程式应为2B+O2=Cl2+2NO2,可知B的分子式为NOCl。
II.(1)NH3转化为N2H4,N元素化合价升高,NH3作还原剂,氧气作氧化剂,所以通入氧气的电极为正极;NH3失去电子转化为N2H4,根据化合价的变化配平可得电极方程式:2NH3—2e?+2OH?=N2H4+2H2O
(2)肼(N2H4)可以在纯氧中燃烧生成氮气和水,电解质为能够传导H+的固体电解质,所以负极上N2H4失电子生成N2和H+,电极方程式为:N2H4—4e?=N2+4H+
本题难度:一般
4、填空题 (11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
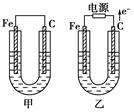
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。
参考答案:(1)①碳; 铁; ②4OH--4e-===2H2O+O2↑;(2)①2Cl-+2H2O通电Cl2↑+H2↑+2OH-;
②2H2O+O2+4e-===4OH- 氧化反应;③13。
本题解析:由图可知 甲池是原电池,乙池是电解池; (1) ①对于甲池来说,Fe为负极,失去电子,Cu2+在碳棒上得到电子,变为单质Cu附着在上边。所以若两池中均为CuSO4溶液,反应一段时间后碳棒上会有红色的铜单质产生;对于乙池来说,C为阳极,Fe为阴极。所以Cu2+在铁棒上得到电子,变为单质Cu附着在上边。因此反应一段时间后铁棒上会有红色的铜单质产生;②在乙池中OH-的放电能力比SO42-强,所以是OH-在阳极放电。该电极反应式是4OH--4e-===2H2O+O2↑;(2)若两池中均为饱和NaCl溶液,①在乙池中阳离子的放电能力是H+>Na+,所以在阴极上H+放电;阴离子的放电能力是Cl- >OH-,所以是Cl-在阳极上放电。总反应的离子方程式是2Cl-+2H2O通电Cl2↑+H2↑+2OH-;②对于甲池中来说,碳极为正极,由于是中性环境,所以发生的是吸氧腐蚀,在C棒上电极反应式是2H2O+O2+4e-===4OH-;②乙池中碳极是阳极,所以在C棒上发生的反应是氧化反应,反应式是2Cl--2e-= Cl2↑;③若乙池转移0.02 mol e-后停止实验根据反应方程式可知产生OH-的物质的量为0.02 mol,由于V=0.2L,所以c(OH-)=0.1mol/L;根据水的离子积常数可得c(H+)=10-14÷10-1=10-13mol/L所以溶液混匀后的pH=13。
本题难度:一般
5、选择题 把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是(?)
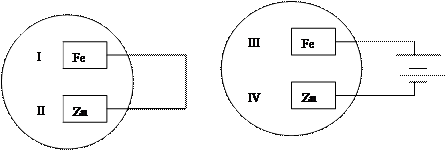
A.I和III
B.I和IV
C.II和III
D.II和IV
参考答案:B
本题解析:略
本题难度:一般