微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、NaOH溶液、盐酸.按要求回答:
(1) 电工操作上规定不能把铜导线和铝导线连接在一起使用.说明原因? .
(2)若电极材料选铜和石墨,电解质溶液选硫酸铜溶液,外加导线,能否构成原电池??,若能,请写出电极反应式,负极?,正极 ??.(若不能,后面两空不填)
(3)通常说的燃料电池都以铂为电极,将燃烧反应的化学能转化为电能,在燃料电池中,可燃物在 ??极反应, ?在另一极反应。
参考答案:(1)铜铝接触在潮湿的环境中形成原电池反应,加快了铝腐蚀的速率,易造成电路断路。(2)能、负极反应式为2Cu-4e-=2Cu2+;正极反应式为O2+4H++4e-=2H2O (3)负、助燃物
本题解析:(2)铜虽然是活泼性弱的金属,但不是惰性电极,铜与石墨导线连接在盐溶液中可以构成原电池装置,铜作负极。正极反应是溶解在溶液中的氧气得电子,酸性溶液中的电极反应为:O2+4H++4e-=2H2O,中性或弱碱性溶液中的电极反应式为:O2+2H2O+4e-=4OH-。
本题难度:简单
2、选择题 在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确( )
A.电子从原电池的负极通过导线移动向正极
B.电子从原电池的正极通过导线移动向负极
C.阴离子在电解质溶液中向正极移动
D.阳离子在电解质溶液中向负极移动
参考答案:A
本题解析:原电池中负极失去电子,通过导线传递到正极。所以溶液中的阳离子向正极移动,则阴离子向负极移动,答案选A。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,而溶液是不可能传递电子的,溶液是通过离子的定向运动而导电的,据此可以进行有关的判断。
本题难度:一般
3、选择题 下列关于如图所示装置的叙述,正确的是( )
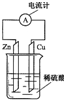
A.铜片是负极,锌片上有气泡产生
B.锌片和铜片都不断溶解,溶液逐渐变为蓝色
C.该装置可以将电能转化为化学能
D.电子从锌片流出,经导线流向铜片
参考答案:A、活泼金属锌作负极,铜作正极,负极上锌失电子,正极铜上氢离子得电子生成氢气,故A错误;
B、锌作负极,锌失电子生成锌离子进入溶液,导致锌片的质量减轻;铜片上氢离子得电子生成氢气,铜片质量不变,故B错误;
C、原电池是将化学能转换为电能的装置,故C错误;
D、电子从负极沿导线流向正极,即电子从锌片流出,经导线流向铜片,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 在室温下,1L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO3- | Cl-
C(mol/L)
1
1
4
a
|
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电解产物可能存在的溶解现象)下列说法不正确的是( )
A.电解后溶液的PH=0
B.阳极与阴极析出的气体物质的量之比为2:1
C.阴极析出64g铜
D.阳极电解反应:2Cl--2e-=Cl2↑
参考答案:根据溶液呈电中性,溶液中阴阳离子所带电荷相等得氯离子浓度为:1mol/L×1L×2+1mol/L×1L×3=4mol/L×1L×1+nmol/L×1L×1,n=1.
A、n(Cu2+)=1mol/L×1L=1mol,n(Cl-)=1mol/L×1L=1mol,当电路中有3mole-通过时,阴极上除了铜离子全部析出后,还析出氢气;由Cu2+----2e-知,析出铜需要电子的物质的量为2mol,根据2H+---2e----H2知,得1mol电子需要1mol氢离子反应;阳极上除了生成氯气外还有氧气生成,根据2 e-----Cl2,氯离子完全析出需要1mol电子,4OH----4e-知,2mol电子需要2mol氢氧根离子放电,放电的氢离子的物质的量小于氢氧根离子的物质的量,溶液中氢离子浓度为1mol/l,所以pH=0,故A正确.
B、通过3mol电子时,根据2H+---2e----H2知阴极上析出氢气的物质的量为0.5mol,根据2 e-----Cl2,阳极上析出氯气的物质的量为0.5mol,根据4OH----4e----O2知,生成氧气的物质的量为0.5mol,所以阳极与阴极析出的气体物质的量之比为1mol:0.5mol=2:1,故B正确.
C、溶液中铜的物质的量为1mol,由Cu2+----2e-知,当转移3mol电子时,阴极上不仅析出铜还析出氢气,所以铜完全析出,1mol铜的质量是64g,故C正确.
D、当转移3mol电子时,阳极上不仅析出氯气还析出氧气,所以电极反应式有:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,故D错误.
故选D.
本题解析:
本题难度:一般
5、填空题 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为2L 2mol/LKOH溶液),通过装置Ⅱ制备稀H2SO4。若持续通入甲烷,在标准状况下,消耗甲烷的体积V L。
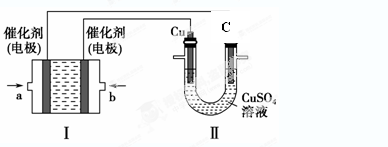
①0<V≤44.8时,装置Ⅰ的总反应方程式为: 。
②44.8<V≤89.6时,装置Ⅰ中负极电极反应为: 。
③装置Ⅱ中C棒上的电极反应式为: 。
④ 若装置Ⅰ中消耗的甲烷在标况下的体积为22.4L,则装置Ⅱ中理论上生成的H2SO4的物质的量为 mol。
参考答案:(1)CH4+2O2+2KOH=K2CO3+3H2O (2)?CH4+2O2+2KOH=K2CO3+3H2O ?CH4-8e-+9CO32-+3H2O=10OH- ?4OH--4e-=O2↑+2H2O ?4
本题解析:
试题解析:(1)CH4(g)+CO2(g)
本题难度:一般