微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:⑴称取3.32g天然碱样品,加入30mL过量稀盐酸,产生672mL CO2气体(标准状况);⑵另称取3.32g天然碱样品,在300℃下加热至分解完全,产生CO2 112mL(标准状况)和0.45g水。试通过计算,确定天然碱的化学式。
参考答案:2Na2CO3·NaHCO3·2H2O
本题解析:略
本题难度:一般
2、选择题 在四个烧杯内分别加入200mlH2O(足量),然后各加入:①钠、②氧化钠、③过氧化钠、④氢氧化钠固体,搅拌使之完全溶解,则四个烧杯内所得溶液的质量分数的大小顺序正确的是
A.若固体的质量相等,则:②=③>①>④
B.若固体的物质的量相等,则:②=③>①>④
C.若固体的质量相等,则:③>②>④>①
D.若固体的物质的量相等,则:①>②>③>④
参考答案:B
本题解析:如果固体的质量相等,则钠生成的氢氧化钠最多,浓度增大,AC不正确;如果固体的物质的量相等,则①④中氢氧化钠相等,但都小于②③中氢氧化钠。由于钠和水反应放出氢气,所以①浓度大于④;过氧化钠的化学式可以看作是Na2O·O,所以②③中溶液的质量相等,能使相同,答案选B。
本题难度:简单
3、填空题 (14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
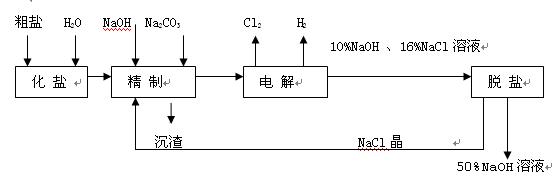
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为?,与电源负极相连的电极附近,溶液pH值?(选填:不变、升高或下降)?
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为??,?
( 3)为有效除去Ca2+、Mg2+、SO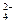 ,加入试剂的合理顺序为?(选填a,b,c多选扣分)
,加入试剂的合理顺序为?(选填a,b,c多选扣分)
a?先加NaOH,后加Na2CO3,再加钡试剂
b?先加NaOH,后加钡试剂,再加Na2CO3
c?先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过?、冷却、?(填写操作名称)除去NaCl?
(5)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
参考答案:(1)? 2Cl--2e-=Cl2↑?( 2分)升高 ( 2分) (2)Ca2++CO32-= CaCO3↓,( 2分) Mg2++2OH-=Mg(OH)2↓?( 2分)
(3)b、c ( 2分) (4)蒸发; 过滤 (每空1分,共2分)
(5)2NaCl + 2H2O?="?2NaOH" + H2↑+ Cl2↑ Cl2+2NaOH=2NaClO+H2↑
或(2NaCl + 2H2O?="?2NaClO" + 2H2↑)?( 2分)
本题解析:略
本题难度:一般
4、选择题 在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来的温度,下列说法正确的是(?)
A.溶液中Na+浓度增大,有O2放出
B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出
D.溶液中Na+总数减少,有O2放出
参考答案:D
本题解析:饱和溶液中的水,参加化学反应,使钠离子的浓度减少,析出更多的氢氧化钠。
本题难度:简单
5、填空题 根据下列转化关系以及现象回答:
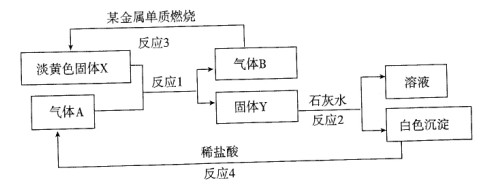
(1)固体X的名称是??,Y的化学式是??。
(2)写出反应l的化学方程式??。
(3)写出反应2的化学方程式?。
(4)若15.6g X和足量水反应,转移?mol e-。
参考答案:(1)过氧化钠? Na2CO3(2)2Na2O2+2CO2=2Na2CO3+O2(3)Na2CO3+Ca(OH)2= CaCO3↓+2NaOH(4)0.2
本题解析:(1)Na2CO3能与水及二氧化碳发生反应,所以与它反应的气体A是二氧化碳。(2)反应产生碳酸钠和氧气。固体Y是碳酸钠,气体B是氧气。钠在氧气中燃烧得到过氧化钠淡黄色固体。反应的方程式:2Na2O2+2CO2=2Na2CO3+O2。(3)二氧化碳与氢氧化钙发生反应产生碳酸钙沉淀和水。反应的方程式为:Na2CO3+Ca(OH)2= CaCO3↓+2NaOH。碳酸钙与盐酸发生反应生成氯化钙、水和二氧化碳。(4)Na2O2化学式的式量是78,15.6g过氧化钠的物质的量是0.2mol.根据化学方程式:2Na2O2+2H2O=4NaOH+O2↑可知若有2mol过氧化钠反应,转移电子2mol.现在有0.2mol发生反应,所以转移电子0.2mol.
本题难度:一般