微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)?2NH3(g)反应的图象中,错误的是( )
A.

B.

C.
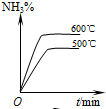
D.
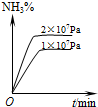
参考答案:A、工业合成氨的正反应是放热反应,温度升高平衡向逆反应方向移动,逆反应速率大于正反应速率,故A正确;
B、温度升高,平衡逆向移动,氨气的百分含量降低,故B正确;
C、温度升高反应速率加快,先达到平衡状态,温度升高平衡向逆反应方向移动,氨气的百分含量降低,故C错误;
D、反应物的化学计量数之和大于生成物的计量数之和,增大压强平衡向正方向移动,氨气的百分含量增大,故D正确.
故选C.
本题解析:
本题难度:简单
2、实验题 (8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
实验编号
| 锌的状态
| 反应温度/℃
| 收集100mL氢气所需时间
|
①
| 薄片
| 15
| 200
|
②
| 薄片
| 25
| 90
|
③
| 粉末
| 25
| 10
|
(1)该实验的目的是研究??、?对锌和稀盐酸反应速率的影响。
(2)实验①和②表明??;
(3)能表明固体的表面积对反应速率影响的实验编号是??和??。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条??。?
参考答案:(1)温度和固体的接触面积(固体的形状)
(2)其它条件不变时,升高温度,化学反应速率加快;?(3)②和③
(4)增加盐酸的浓度、加入少量的硫酸铜形成原电池(加入铜粉)或用粗锌
本题解析:(1)在反应中锌的固体表面积和反应的温度是不同的,所以实验的目的是研究温度和固体的接触面积对反应速率的影响的。
(2)实验①②中温度不同,温度越高,收集等条件氢气所用的时间就越少,即温度升高,反应速率加快。
(3)实验②③中温度相同,但固体的表面积是不同的。
(4)影响化学反应速率的因素除了温度和固体的接触面积之外,还可以是反应物的浓度,或者通过原电池反应来加快反应速率等。
本题难度:一般
3、选择题 向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时, 按正反应速率由大到小的顺序排列,正确的是
①500 ℃, 10 mol SO2和5 mol O2反应 ?
②500 ℃, 用V2O5作催化剂, 10 mol SO2和5 mol O2反应?
③450 ℃, 8 mol SO2和5 mol O2反应?
④500 ℃, 8 mol SO2和5 mol O2反应。
A.②①④③
B.②①③④
C.①②③④
D.④③②①
参考答案:A
本题解析:①与②相比,②中使用催化剂,其它条件相同,使用催化剂反应加快,所以反应速率:②>①;①与④相比,①中SO2的物质的量比④中大,即SO2的浓度比④中大,其它条件相同,浓度越大,反应速率越快,所以反应速率:①>④;③与④相比,其它条件相同,④中温度高,温度越高,反应速率越快,所以反应速率:④>③,所以由大到小的顺序排列②①④③,答案选A。
点评:该题主要是考查学生对影响反应速率因素的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。学会用控制变量法探究外界因素对反应速率影响是解题的关键。
本题难度:一般
4、选择题 下图所示是用稀硫酸与锌反应测定反应速率的装置,在分液漏斗中加入稀硫酸,在锥形瓶中加入锌,通过测定产生一定量气体所用的时间来测定反应的速率.现用50?mL?1?mol/L硫酸,在锥形瓶中加入下列各种锌(总质量相同),其中产生H2最快的是

[? ]
A.纯的锌粒
B.纯的锌粉
C.含少量铜杂质的锌粒?
D.含少量铜杂质的锌粉
参考答案:D
本题解析:
本题难度:一般
5、填空题 ?某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
实验
混合溶液
| ? A
| ? B
| ? C
| ? D
| ? E
| ? F
|
4mol/L ?H2SO?4/mL
| ? 30
| ? V1
| ?V2
| ? V3
| ? V4
| ? V5
|
饱和CuSO4溶液? /mL
| ? 0
| ? 0.5
| ? 2.5
| ? 5
| ? V6
| ? 20
|
H2O? /mL
| ? V7
| ? V8
| ? V9
| ? V10
| ? 10
| ? 0
|
①请完成此实验设计,其中:V1=?,V6=?,V9=?;
②?该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因?
参考答案:(1) CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率? (2分)?
(2)? CuCl2、(1分)
(3)升高反应温度、适当增大硫酸的浓度、或增加锌的比表面积等(2分)
(4)①30 10 17.5 (3分)
②当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积(2分)
本题解析:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率,因此能起到相似作用的应该是含有铜离子的,所以为氯化铜。影响化学反应速率的因素有,温度,催化剂,浓度,压强,反应物的接触面积。AB应比较的是硫酸铜溶液对该反应的影响。因此硫酸的量应与A的相同,所以V1=30?据表格可知,CDEF应该是呈两倍的关系递增,所以V6="10" 。从图表可知饱和硫酸铜的体积与水的体积之和应为20毫升。所以V9应为20减去2.5等于17.5. :当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降主要是由于当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积
本题难度:一般