| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡》高频试题特训(2017年最新版)(二)
 参考答案:AB 本题解析: 本题难度:简单 2、选择题 下列事实不能用勒夏特列原理解释的是 |
参考答案:D
本题解析:勒夏特列原理适合解释化学平衡的移动。过量的氧气使2SO2(g)+O2(g)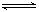 2SO3(g),平衡右移,二氧化硫的转化率增大,故A项正确;N2(g)+3H2(g)
2SO3(g),平衡右移,二氧化硫的转化率增大,故A项正确;N2(g)+3H2(g)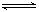 2NH3(g),增大压强,平衡右移,故B正确;Cl2+H2O
2NH3(g),增大压强,平衡右移,故B正确;Cl2+H2O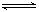 H++Cl—+HClO,在高浓度的氯化钠溶液中,氯气的溶解度减小,度C正确;经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全,平衡不移动,故D错误。
H++Cl—+HClO,在高浓度的氯化钠溶液中,氯气的溶解度减小,度C正确;经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全,平衡不移动,故D错误。
考点:本题考查化学试剂的标志。
本题难度:一般
3、填空题 以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下: 
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为___。在(NH4)2SO4溶液中,存在NH4+ +H2O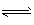 NH3·H2O+H+,该反应的平衡常数表达式为K=___ 。
NH3·H2O+H+,该反应的平衡常数表达式为K=___ 。
(2)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为___。
(3)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为___ 。
(4)综上分析,流程图中M的主要成分的化学式为___,M可用一种物质吸收以实现循环利用,该物质的名称是___。 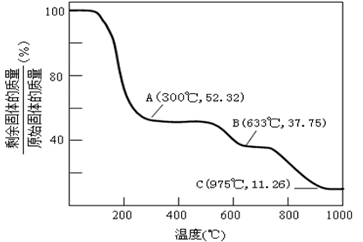
参考答案:(1)2Fe2+ +H2O2+2H+=2Fe3+ +2H2O;
(2)NH4Al(SO4)2+5NaOH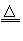 NH3↑+3H2O+NaAlO2+ 2Na2SO4
NH3↑+3H2O+NaAlO2+ 2Na2SO4
(3) Al2(SO4)3
(4)NHa、H2O、SO3?; 浓硫酸或水
本题解析:
本题难度:一般
4、填空题 硫酸工业中接触氧化是最重要的一个反应:2SO2(g) + O2(g)  2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
| 时间/min | 10 | 20 | 30 | 40 | 50 |
| N(SO3)/mol | 0.4 | 0.6 | 1.2 | 1.6 | 1.6 |
参考答案:(1)0.01mol/(L·min) (2)160 (3)增大 (4)39.4
本题解析:
试题解析:(1)反应前10 min,用SO3表示该反应的反应速率v(SO2)=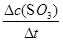 =
=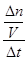 =
=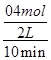 =0.02mol/(L·min),利用速率之比等于计量系数比可知,v(O2)=
=0.02mol/(L·min),利用速率之比等于计量系数比可知,v(O2)=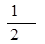 v(SO2)=0.01mol/(L·min);(2)由表中数据可知,40分钟达到平衡,则可逆反应: 2SO2(g) + O2(g)
v(SO2)=0.01mol/(L·min);(2)由表中数据可知,40分钟达到平衡,则可逆反应: 2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
起始浓度(mol/L) : 1 0.5 0
变化浓度(mol/L) :0.8 0.4 0.8
平衡浓度(mol/L) :0.2 0.1 0.8
该反应的平衡常数K=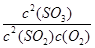 =
=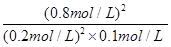 =160;(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,在体积不变的条件下,物质的量同时扩大1倍,相当于增大压强,平衡向正反应方向移动,达到新平衡后,SO2的转化率将增大;(4)保持温度不变,若在该容器中只投入2mol SO3,与上述可逆反应相比较,相当于由逆反应建立平衡,两者是等效的,达平衡时 SO3的浓度为0.8mol/L,转化的浓度=1mol/L-0.8mol/L=0.2mol/L,则SO3的转化率=
=160;(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,在体积不变的条件下,物质的量同时扩大1倍,相当于增大压强,平衡向正反应方向移动,达到新平衡后,SO2的转化率将增大;(4)保持温度不变,若在该容器中只投入2mol SO3,与上述可逆反应相比较,相当于由逆反应建立平衡,两者是等效的,达平衡时 SO3的浓度为0.8mol/L,转化的浓度=1mol/L-0.8mol/L=0.2mol/L,则SO3的转化率=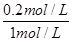 =20%,反应吸收的热量为197kJ/mol×20%=39.4KJ。
=20%,反应吸收的热量为197kJ/mol×20%=39.4KJ。
考点:化学反应速率、化学平衡
本题难度:一般
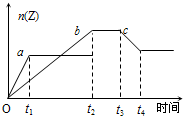
5、选择题 下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是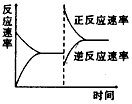
[? ]
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《炔烃的性质.. | |