微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应都是用浓盐酸制Cl2,为制得等量Cl2,消耗盐酸最多的是( )
A.MnO2+4HCl
MnCl2+2H2O+Cl2↑
B.KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl→KCl+3Cl2↑+3H2O
D.4HCl+O22H2O+2Cl2
E.4HCl+O22H2O+2Cl2
参考答案:A
本题解析:
本题难度:简单
2、实验题 某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4==2CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。
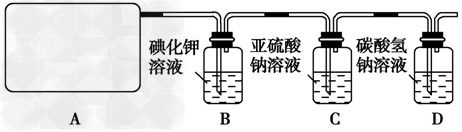
试回答:
(1)该实验中A部分的装置是________(填写装置的序号);
试回答:
(2)该实验中A部分的装置是________(填写装置的序号);
(3)B中反应的化学方程式是______________。
(4)写出C中反应的离子方程式______________,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):________________。
(4)写出在D装置中发生反应的离子方程式____________________。
(5)该实验存在明显的缺陷是__________________________________。
(6)该小组又进行了如下实验:称取漂白粉2.0?g,研磨后溶解,配制成250?mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1?mol/L的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3?200?mL。则该漂白粉中Ca(ClO)2的质量分数为_______。
参考答案:(1)b?
(2)Cl2+2KI=2KCl+I2?
(3)Cl2+SO32-+H2O=SO42-+2Cl-+2H+;取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化
(4)Cl2+H2O H++Cl-+HClO,HCO3-+H+=H2O+CO2↑(或者Cl2+ HCO3-=CO2↑+Cl-+HClO)
H++Cl-+HClO,HCO3-+H+=H2O+CO2↑(或者Cl2+ HCO3-=CO2↑+Cl-+HClO)
(5)无尾气处理装置
(6)35.8%(或35.75%)
本题解析:
本题难度:一般
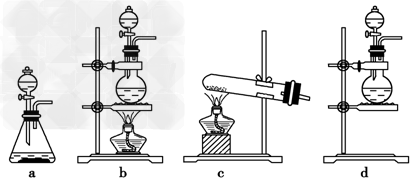
3、简答题 图1是实验室制取氯气的装拦图,根据要求填空回答.
(1)填写仪器名称:图中①是______
(2)烧瓶中发生反应的化学方程式是______
(3)如图2所示,在硬质玻璃管中的A、B、C三处放有喷上少量KBr溶液、KI溶液、淀粉溶液的三个棉球.向左端导入Cl2,在B处加热,可观察到A处棉球呈______色,B处棉球呈______色,C处棉球呈______色.
(4)若制备饱和氯水,应选用的最佳吸收装置如图3是______
(5)若实验中使用12mol/L的浓盐酸10ml与足量的MnO2反应,则生成Cl2的物质的量是______
A.大于O.03molB.小于O.03molC.等于0.93mol.
参考答案:(1)向圆底烧瓶中加液体,根据装置图可知仪器①为分液漏斗,故答案为:分液漏斗;
(2)在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,其反应的化学方程式为:4HCl(浓)+MnO2△.MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2△.MnCl2+Cl2↑+2H2O;
(3)氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,溴水为橙色,A处棉球呈橙色,B处棉球中生成的碘单质溶液呈黄色,碘单质遇到淀粉变蓝色,所以C处棉球先蓝色,故答案为:橙;黄;蓝;
(4)A、氯气溶解度不大,易挥发,故A不选;
B、氯气的溶解度不大,不需要防倒吸,所以不用B装置,故B不选;
C、C装置密封,气体难以通入,故C不选;
D、氯气易挥发,D装置能加大氯气与水的接触面积,有利于氯气的吸收,故D选;
故答案为:D;
(5)实验中使用12mol/L的浓盐酸10ml与足量的MnO2反应,若HCl全部反应则生成O.03mol 氯气,实际上当反应进行到一定程度浓盐酸变稀,反应会停止,所以氯化氢不能全部反应,故 生成Cl2的物质的量小于O.03mol,
故答案为:B.
本题解析:
本题难度:一般
4、简答题 氨在人类的生产和生活中有着广泛的应用.某化学兴趣小组利用图一装置探究氨气的有关性质.
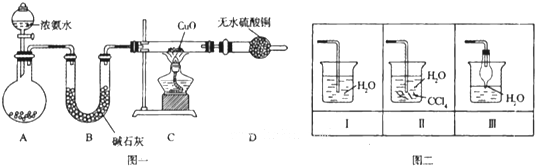
(1)装置A中烧瓶内试剂可选用______(填序号).B的作用是______.
a.碱石灰b.浓硫酸c.生石灰d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先______(填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为______.该反应证明氨气具有______性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是______(填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为______mol/L.
参考答案:(1)装置A是制备氨气的发生装置,浓氨水滴入固体碱石灰或氧化钙或固体氢氧化钠都可以生成氨气,浓硫酸和氨气发生反应,氨气易溶入烧碱溶液,不选择浓硫酸、氢氧化钠溶液制备氨气,所以装置A中试剂为:a.碱石灰,c.生石灰;B装置中的碱石灰是吸收水蒸气,干燥氨气的作用,
故答案:ac;干燥氨气;
(2)连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,故答案为:Ⅰ;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3△.3Cu+N2+3H2O;氮元素化合价升高为0价,做还原剂具有还原性,
故答案为:3CuO+2NH3△.3Cu+N2+3H2O;还原性;
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,溶质氨气物质的量为0.1mol,所得溶液的物质的量浓度=0.1mol0.5L=0.2mol/L,
故答案为:0.2.
本题解析:
本题难度:一般
5、简答题 Cl2的实验室制取与性质验证是高中化学实验的基础实验之一,结合所给装置图Ⅰ、Ⅱ、Ⅲ,回答下列问题.
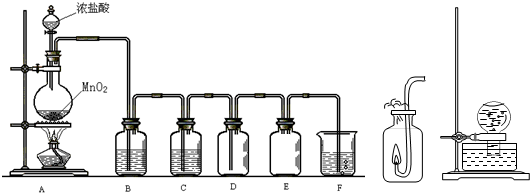
(1)在制取有毒气体时,通常使用“制备→净化→干燥→收集→尾气处理”五部分装置.在图Ⅰ中E、F属于尾气处理装置,其中E的作用是______.
(2)写出图Ⅰ圆底烧瓶中发生反应的化学方程式______;在F所指的装置中,通常盛放的试剂为______,写出该装置中发生的离子反应方程式______.
(3)请你结合图Ⅱ,描述该实验的实验现象______.
(4)将装有饱和氯水的烧瓶,倒置于水槽中,放置在阳光直射处,如图Ⅲ所示.一段时间后,可以观察有气泡产生,该反应的化学方程式为______.
(5)用高锰酸钾和浓盐酸在室温下就能很快制得氯气,由此可以比较二氧化锰和高锰酸钾中氧化性较强的是______.
参考答案:(1)装置E是安全瓶,可以防止溶液倒吸;
故答案为:防止倒吸;
(2)圆底烧瓶中发生反应的化学方程式是实验室制备氯气的化学方程式,反应方程式为:2+4HCl(浓)△.MnCl2+Cl2↑+2H2O,装置F是吸收过量的氯气房子和污染空气,需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O;NaOH溶液、Cl2+2OH-=Cl-+ClO-+H2O;
(3)氢气在氯气安静燃烧发出苍白色火焰,生成的氯化氢在瓶口遇到空气中的水蒸气形成白色雾;
故答案为:H2在Cl2中安静燃烧,发出苍白色火焰,瓶口有白雾生成;
(4)装有饱和氯水的烧瓶,倒置于水槽中,放置在阳光直射处,一段时间后,可以观察有气泡产生,氯水中的次氯酸见光分解生成盐酸和氧气,反应的化学方程式为:2HClO 光.2HCl+O2↑;
故答案为:2HClO光.2HCl+O2↑;
(5)用高锰酸钾和浓盐酸在室温下就能很快制得氯气,二氧化锰和浓盐酸需要加热反应生成氯气,所以高锰酸钾氧化性大于二氧化锰;
故答案为:高锰酸钾.
本题解析:
本题难度:一般