微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| X的某种氢化物能使湿润的红色石蕊试纸变蓝
|
Y
| 单质是良好的半导体材料,广泛应用于光电信息领域
|
Z
| Z的一种核素质量数为27,中子数为14
|
W
| 最高价氧化物对应的水化物是一种不溶于水的蓝色固体
|
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。
参考答案:
(1)三 ⅢA 1s22s22p63s23p63d94s2
(2)大 1:2 原子
(3)NaClO+2NH3=N2H4+NaCl+H2O
(4)2Cu2O(s)+O2(g)=4CuO(s) △H=一292.0kJ·mol—1
本题解析:根据题意可以推知X、Y、Z、W分别为N、Si、Al、Cu。
(1)Cu为29号元素,故其电子排布式为[Ar]3d94s2;
(2)同周期从上到下,第一电离能依次减小,有N>P;P为3p3,半充满结构,P>Si;因此N>P>Si;氮氮三键中有1个σ键和2个π键;SiO2为原子晶体。
(3)由反应物和产物可以写出
(4)目标反应等于反应②×2-①,根据盖斯定律可得。
考点:本题以物质结构为基础,考查了原子结构、分子结构、晶体结构、元素周期律、盖斯定律及热化学方程式的书写等相关知识。
本题难度:困难
2、选择题 反应2C+O2=2CO的能量变化如下图所示。下列说法正确的是
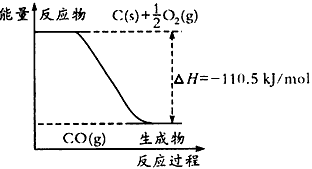
[? ]
A.12g C(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ/mol
C.该反应的热化学方程式是:2C(s) +O2(g)=2CO(g) △H= -221kJ/mol
D.碳的燃烧热为110. 5 kJ/mol
参考答案:B
本题解析:
本题难度:简单
3、选择题 含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6 kJ。下列热化学方程式中,正确的是
[? ]
A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)? ? ΔH=+114.6 kJ/mol
B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)? ΔH=-114.6 kJ/mol
C.1/2Ba(OH)2(aq)+HCl(aq)=1/2BaCl2(aq)+H2O(l)? ΔH=-57.3 kJ/mol
D.1/2Ba(OH)2(aq)+HCl(aq)=1/2BaCl2(aq)+H2O(l)? ? ΔH=+57.3 kJ/mol
参考答案:BC
本题解析:
本题难度:简单
4、填空题 (14分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH=-44.0 kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=
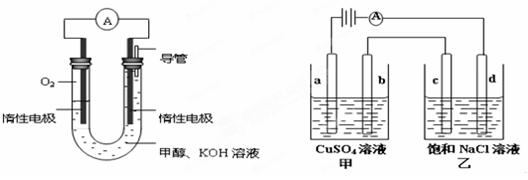
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池负极的电极反应为 。
②工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况),电解后向甲中加入适量下列某一种物质,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
A.CuO
B.CuCO3
C.Cu(OH)2
D.Cu2(OH)2CO3