微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________________。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除外Fe3+还可能含有Fe2+。若要确认其中的Fe2+,应先用____________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: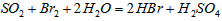
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为
_______。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
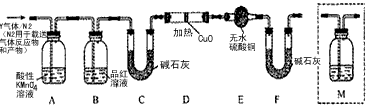
(3)装置B中试剂的作用是____________________。
(4)认为气体Y中还含有Q的理由是________________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于_______________(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是____________________。
(7)若要测定限定体积气体Y中的H2含量(标准状况下约有28ml H2?),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由____________________________________。
参考答案:(1)铁钉表面被钝化(答案合理即可)
(2)①d;②66.7%
(3)检验SO2是否除尽
(4)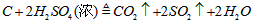
(5)c
(6)D中固体由黑变红和E中固体由白变蓝
(7)否,用托盘天平无法称量D或E的差量(或:可,用分析天平称量D或E的差量)
本题解析:
本题难度:困难
2、简答题 某100mL溶液中仅含下表中的5种离子(不考虑水的电离及离子的水解),且各离子的物质的量均为0.1mol.
| 阴离子 | SO42-、NO3-、Cl-
阳离子
Fe3+、Fe2+、NH4+、Cu2+、Al3+
|
①若向溶液中加入KSCN溶液,无明显变化
②若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
③若向溶液中加入BaCl2溶液,有白色沉淀生成.
试回答下列问题:
(1)原溶液中所含阳离子是(写离子符号,后同)______,阴离子是______.
(2)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤、洗涤、灼烧,最终所得固体的质量是______.
(3)向原溶液中加入足量盐酸后,发生反应的离子方程式是______.
(4)用排水法收集所产生的气体并使气体恰好充满容器,仍将容器倒置于水槽中,再向容器中通入______mLO2(气体体积均指标准状况),能使溶液充满该容器.此时容器内溶液的物质的量浓度为______mol/L.
参考答案:(1)若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+;阴离子是NO3-、Cl-、SO42-,
故答案为:Fe2+、Cu2+;NO3-、Cl-、SO42-;
(2)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,根据题意各离子的物质的量均为0.1mol可知m(CuO)=0.1mol×80g/mol=8g,m(Fe2O3)=12×0.1mol×160g/mol=8g,所得固体的质量为8g+8g=16g,
故答案为:16g;
(3)加入盐酸,具有氧化性的NO3-和还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(4)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
?3mol? 1mol? 1mol
? 0.1mol? n(NO)
n(NO)=0.13mol,
? 4NO+3O2+2H2O=4HNO3
? 4mol ?3mol? 4mol
0.13mol n(O2)?n(HNO3)
n(O2)=0.13mol×34=0.14mol,
V(O2)=0.14mol×22.4×1000mL/mol=560mL,
?n(HNO3)═0.14mol,
容器体积=V(NO)=0.13mol×22.4L/mol=0.13×22.4L,
此时容器内溶液的物质的量浓度为0.13mol0.13×22.4L=122.4mol/L=0.045mol/L,
故答案为:560;0.045或122.4.
本题解析:
本题难度:一般
3、实验题 (14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。
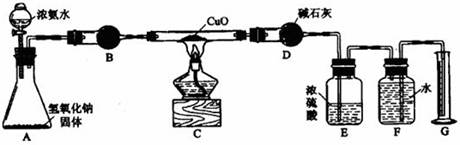
⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是?。
⑸E装置中盛装浓硫酸的目的是?。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为?mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为?。(用含a、b字母的代数式表示)
参考答案:⑴2NH3+3CuO N2+3Cu+3H2O (2分)
N2+3Cu+3H2O (2分)
⑵NaOH固体吸水及溶解产生的热利于氨气的逸出。(2分)
⑶C (2分)
⑷黑色粉末变为光亮的红色固体。(2分)
⑸将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差。(2分)
⑹3a/22.4(2分) 9a/11.2b(2分)
本题解析:考查氨气的制取与性质、分子组成的测定;
实验目的之一是测定氨分子的组成,结合所给装置可看出,通过氨气还原氧化铜,氮元素转化为氮气,可用排水法来测定其体积,而氢元素转化为水,其质量可通过装置D的增重来测得。
(1)氨气中的氮元素为其最低负价,可将氧化铜还原:2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O
(2)此为简易法来制备氨气;在氨水中存在平衡:NH4++OH- NH3·H2O
NH3·H2O NH3+H2O
NH3+H2O
NaOH固体溶解产生大量的热且可产生大量的OH-,均可促使氨气的生成与逸出:NH3·H2O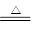 NH3↑+H2O
NH3↑+H2O
(3)氨所碱性氧化,不能用酸性干燥剂来干燥,故答案为C
(4)氧化铜为黑色粉末,被氨气还原为红色的金属铜
(5)为保证装置D只吸收反应所生成的水,可知装置E主要有两个作用,一是吸收未反应的氨气,二是防止装置F中的水气进入装置E中
(6)氨气的物质的量为a/22.4 mol,由化学方程式可知,被还原的氧化铜的物质的量为3a/22.4 mol;
水的物质的量为b/18 mol;所以氨分子中氮、氢的原子个数比为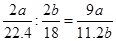
本题难度:一般
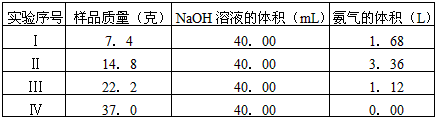
4、实验题 为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积)
(1)实验过程中有关反应的离子方程式为:__________________________。
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为__________________。
(3)计算确定该混合物中(NH4)2SO4和NH4HSO4的物质的量之比______________。
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量浓度
为_____________。
参考答案:(1)NH4++OH-==NH3↑+H2O,H++OH-==H2O
(2)0.42L
(3)1:4
(4)Ⅲ组数据;5mol/L
本题解析:
本题难度:一般
5、选择题 以下实验能获得成功的是( )
A.用酸性KMnO4溶液鉴别乙烯和乙炔
B.将铁屑、溴水、苯混合制溴苯
C.在苯和硝基苯采用分液的方法分离
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
参考答案:D
本题解析:考查物质的鉴别。乙烯和乙炔都能使酸性高锰酸钾溶液褪色,A不正确。苯和液溴在催化剂的作用下生成溴苯,而不是溴苯,B不正确。苯和硝基苯互溶,不能直接分液,C不正确。氧化铜在加热的条件下能把乙醇氧化生成乙醛,而氧化铜被还原生成铜,所以正确的答案是D。
本题难度:简单