微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
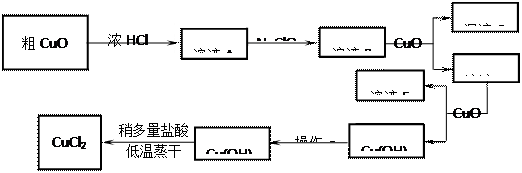
1、实验题 (8分,每空2分)工业上制取CuCl2的生产流程如下:
 ?
?
请结合下表数据,回答下列问题:
物?质
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
|
溶度积/25℃
| 8.0×10-16
| 2.2×10-20
| 4.0×10-38
|
完全沉淀时的pH范围
| ≥9.6
| ≥6.4
| 3~4
|
⑴溶液A中加入NaClO的目的是?;
⑵在溶液B中加入CuO的作用是?;
⑶操作a的目的是?;
⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是?。
参考答案:⑴?将Fe2+氧化为Fe3+而使分离更加完全
⑵调节溶液的pH为3~4,使F e3+完全转变为F
e3+完全转变为F e(OH)3沉淀而分离Fe3+
e(OH)3沉淀而分离Fe3+
⑶洗涤Cu(OH)2表面的可溶性杂质
⑷抑制Cu2+的水解
本题解析:略
本题难度:一般
2、填空题 当前,大量施用氮素化肥是冬小麦获得高产的重要措施之一。
(1)施入土壤的氮素化肥主要以________形式被小麦根部吸收,透气性较好的土壤植物容易吸收氮素化肥,透气性较差的黏质土壤,则根的吸肥力差,这是因为_______________________________________________。
(2)施肥后要及时灌溉,若从麦田流失的水从下图A位置注入一条河流,导致下游水体中藻类和细菌数量发生的变化如下列曲线图所示:
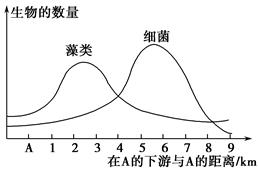
①在A的下游藻类数量增加的原因是____________________________________________________________。
②在3 km以外的河段,细菌数量迅速增加的原因是_____________________________________________________________。
③在下游6 km处的河段发现鱼类大量死亡,原因是______________________________________________________________。
④在距A 2 km处,水中的氧气含量比A处高,原因是______________________________________________________________。
参考答案:(1)NH4+或NO3- 透气性好的土壤中氧气多,呼吸作用旺盛,提供的H+、HCO多,能量多
(2)①氮肥进入河流中引起藻类大量繁殖 ②藻类死亡后,细菌作为分解者得到的有机物多,从而使细菌大量繁殖 ③细菌增多消耗大量的氧气,使鱼类得不到足够的氧气而死亡 ④藻类增多后,进行光合作用产生氧气
本题解析:本题是生物与化学的综合题,同时结合图表的应用能力考查。
本题难度:简单
3、填空题 (8分).某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。试验流程如下:
?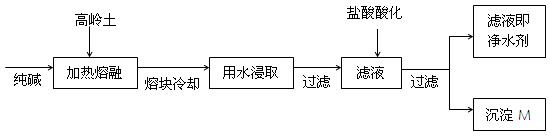
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似。用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式?、
?。
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器?(填写编号)
A.铁坩埚
B.瓷坩埚
C.氧化铝坩埚
D.玻璃坩埚