微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素。少量A与水反应完全水解但不发生氧化或还原反应,所有反应产物均可溶于水。将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸酸化的硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀产生;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀。
⑴由①判断组成该化合物的元素中,肯定存在的卤素有?,由②判断A与水反应后生成的溶液中肯定不存在的离子有? 。由③判断A与水反应后生成的溶液中肯定存在的离子有? .
。由③判断A与水反应后生成的溶液中肯定存在的离子有? .
⑵要确定该化合物的分子式,称取11.90gA溶于水稀释至250.00mL,取25.00mL溶液加入足量的高锰酸钾和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重为2.33g。试确定A的化学式,写出计算推理过程。
2、选择题 下列实验装置(固定装置略去)和操作正确的是( )
A.
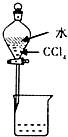
? 分离CCl4和水
B.
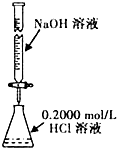
? 酸碱中和滴定
C.
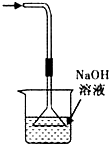
? 吸收HCl尾气
D.
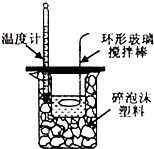
? 中和热的测定
3、填空题 硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5?H2O,硼砂的化学式为Na2B4O7?10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为?,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为?。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为?。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是?。若用惰性电极电解MgCl2溶液,其阴极反应式为 ?。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为??。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为??。已知Ksp[Mg(OH)2]=5.6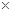 10-12,当溶液pH=6时??(填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时??(填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将? 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为?滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 ?。(提示:I2+2S2O32-=2I-+S4O62-)
4、选择题 36.5 g HCl气体体积是(?)
A.11.2 L
B.22.4 L
C.5.6 L
D.无法确定
5、实验题 (9分)有如下两个反应(反应所需的其他条件和各物质的化学计量数均已略去):
①X+Y Z+P+Q;②Z+Q
Z+P+Q;②Z+Q X+H+Y。请针对以下两种不同情况来完成:
X+H+Y。请针对以下两种不同情况来完成:
(1)若X是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质Q和化合物Z的重要方法。则Z的电子式为___________________;反应①中阴极反应为___________________;反应②的离子方程式为______________;在酸性条件下,若将化合物H加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为_______________________________________。
(2)若X是一种含氧酸盐,可用于实验室中检验水的存在。1个X的酸根离子中共含有50个电子,其中含有一种元素R,R的原子最外层电子数是电子层数的2倍,则R在元素周期表中的位置是_________。X单质的熔点是112.8 ℃,则R单质的晶体类型属于______晶体。
(3)若X是(2)中的含氧酸盐,当以石墨作电极电解X溶液时,阳极反应为___________________;原溶液体积为1升,C(H+)=1×10-6mol/L。电解一段时间,当阳极收集到56ml(标况下)气体是,假定溶液体积不变,阴极棒将增重______g,此时电解质溶液的PH为_____。