微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心。试分析:
(1)在一个晶胞中有____个X,____个Y,所以该晶体的化学式为________。
(2)晶体中距离最近的2个X与一个Y所形成的夹角∠XYX角度为____(填角的度数)。
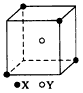
参考答案:(1)1;1/2;XY2
(2)109.5°
本题解析:
本题难度:一般
2、填空题 (15分)图1是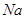 、
、 、
、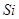 、
、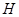 、
、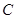 、
、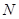 等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是?
等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是?
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含?个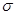 键,?个
键,?个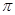 键。
键。
(3)a与b的元素形成的10个电子中性分子X的空间构型为?;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为?,其中X与d 高价离子之间以?键相结合。
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:?。
(5)图中C单质的晶体堆积方式类型是?,这种堆积方式晶胞中原子的配位数为?。
?
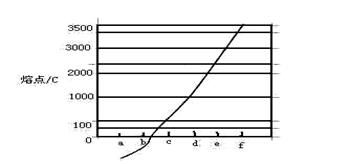 ?
?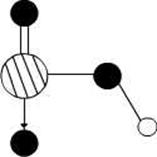
图1?图2
参考答案:(1)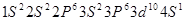 ?(2分)
?(2分)
(2)2? 2 (4分)
(3)三角锥?配位(3分)
(4)硝酸分子是极性分子,易溶于极性溶剂的水中?硝酸分子中氢氧键易与水分子间形成氢键(2分)(5)体心立方堆积? 8(4分)
本题解析:(1)c、d均是热和电的良导体。且d的熔点高于c的,所以c是钠,d是铜,根据构造原理可知电子排布为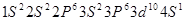 。
。
(2)根据熔点高低可判断,a是氢气,b是氮气,e是硅,f是金刚石。a、b、f对应的元素以原子个数比1:1:1形成的分子是HCN,其中氢和碳是单键,碳和氮是三键,所以含有的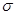 键是2个,?
键是2个,?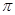 键也是2个。
键也是2个。
(3)a与b的元素形成的10个电子中性分子X是氨气,属于三角锥形。氨气和铜离子可形成配位键,离子的化学式为[Cu(NH3)4]2+。
(4)根据结构模型可判断,化合物是硝酸,硝酸属于极性分子,易溶在极性溶剂中,且硝酸中存在氢键。
(5)金属钠的晶体堆积方式体心立方堆积,配位数是8.
本题难度:一般
3、选择题 已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
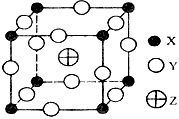
[? ]
A.ZXY3
B.ZX2Y6
C.ZX4Y8
D.ZX8Y12
参考答案:A
本题解析:
本题难度:一般
4、填空题 参考下表中物质的熔点,回答有关问题:
物质
| NaF
| NaCl
| NaBr
| NaI
| NaCl
| KCl
| RbCl
| CsCl
|
熔点/℃
| 995
| 801
| 755
| 651
| 801
| 776
| 715
| 646
|
物质
| SiF4
| SiCl4
| SiBr4
| SiI4
| SiCl4
| GeCl4
| SnCl4
| PbCl4
|
熔点/℃
| -90.4
| -70.4
| 5.2
| 120
| -70.4
| -49.5
| -36.2
| -15
|
? (1)钠的卤化物、碱金属的氯化物的熔点与卤离子、碱金属离子的________有关,随着________的增大,熔点依次降低。
(2)硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与__________有关,随着_________增大,_________增大,故熔沸点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为_______,故前者的熔点远高于后者。
参考答案:(1)半径?离子半径? (2)相对分子质量(或式量)?相对分子质量?分子间作用力
(3)晶体类型?钠的卤化物为离子晶体,硅的卤化物为分子晶体
本题解析:解答本题的思维模式是:分析表中物质及熔点规律,将物质晶型合理分类,由同类晶型熔点变化趋势发现影响熔点高低的规律。
本题难度:简单
5、选择题 某固体仅由一种元素组成,其密度为5.0g·cm-3。用X射线研究该固体的结构得知:在边长为10-7cm的正 方体中含有20个原子。则此元素的相对原子质量最接近于下列数据中的
[? ]
A.32
B.120
C.150
D.180
参考答案:C
本题解析:
本题难度:一般