1、选择题 用Zn片、Cu片和稀硫酸组成的电池装置。下列有关该装置的说法不正确的是(? )?
A.该装置将化学能转变为电能
B.溶液中的阳离子向锌电极移动
C.Cu极上有气泡产生,发生还原反应
D.电流方向是从铜片流向锌片
参考答案:B
本题解析:A、Zn片、Cu片和稀硫酸组成原电池,把化学能转化为电能,正确;B、该原电池中Zn作负极,Cu作正极,所以溶液中的阳离子移向正极Cu,错误;C、Cu是正极,发生还原反应,有氢气放出,正确;D、电流从正极流向负极,所以电流方向是从铜片流向锌片,正确,答案选B。
本题难度:一般
2、填空题 (5分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl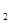 溶液、Fe
溶液、Fe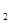 (SO
(SO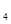 )
)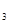 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
参考答案:
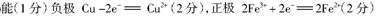
本题解析:略
本题难度:一般
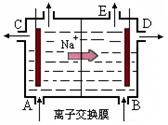
3、填空题 (12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H2,电解食盐水的离子方程式为:?,溶液变红色的是:?区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极??正极?
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计
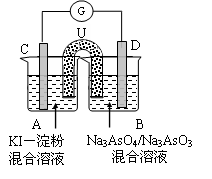
此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+ ?AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是?D电极上的电极反应式为?
?AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是?D电极上的电极反应式为?
参考答案:⑴2Cl-+2H2O Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
⑵吸氧腐蚀的电极反应式:负极? Fe- 2e-=Fe2+?正极? O2+4e-+2H2O=4OH-?
⑶实验现象是?溶液由无色变蓝色?电极反应式为? AsO43-+2e-+2H+=AsO33-+H2O
本题解析:(1)电解时在溶液中阳离子Na+、H+的放电能力H+ >Na+,所以在阴极发生反应:2H++2e-= H2↑,随着H+的不断放电,破坏了附近的水的电离平衡,最终使附近的水溶液显碱性,所以滴加酚酞溶液变为红色。即B区溶液变为红色;由于阴离子的沸点能力:Cl->OH-,在阳极Cl-放电产生氯气2Cl—2e-= Cl2↑,电解的总方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
本题难度:一般
4、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O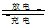 Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
[? ]
A.充电时阳极反应:Ni(OH)2-e-+OH-= NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
A.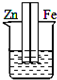
B.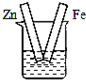
C.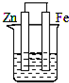
D.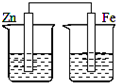
参考答案:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,A、B和C都符合原电池的构成条件,所以能形成原电池,D中不能构成闭合回路,所以不能构成原电池,
故选D.
本题解析:
本题难度:简单