1、实验题 某同学为了验证Fe3+是否能氧化H2SO3生成SO,他用50 mL 0.1 mol·L-1 FeCl3溶液吸收制取SO2气体的尾气后,进行以下实验:
(1)检验吸收液中的SO42—:_____________________________,
证明Fe3+能够把H2SO3氧化成SO42—。
(2)请完成并配平上述反应中的化学方程式:
2FeCl3+SO2+________===________+H2SO4+________,反应中的氧化产物是________(写化学式)。
(3)吸收液中除了含有H+、Cl-、SO42—以外,对其他成分(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在________。
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:试管、滴管、0.1 mol·L-1KMnO4溶液、0.1 mol·L-1KSCN溶液、品红稀溶液。
实验步骤
| 预期现象和结论
|
步骤1:用试管取样品溶液2~3 mL,再用滴管取_________
| 若出现红色,则假设1成立;若未出现红色,则假设1不成立(或假设2成立)
|
步骤2:
| ?
|
步骤3:
| ?
|
?
参考答案:(1)取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀生成
(2)2H2O 2FeCl2 2HCl H2SO4
(3)①Fe2+、H2SO3
②
实验步骤
预期现象和结论
步骤1:0.1 mol·L-1 KSCN溶液,向试管中滴入1~2滴
?
步骤2:另取2~3 mL样品溶液于试管中,滴入1~2 mL品红稀溶液
若品红稀溶液红色褪去,则假设2成立;若品红稀溶液不褪色,则假设2不成立
本题解析:(3)验证“假设2”不能使用KMnO4溶液,因为它可以同时氧化Fe2+和H2SO3。用FeCl3溶液吸收制取SO2气体的尾气,Fe3+可以氧化H2SO3,故Fe3+与H2SO3不能共存,溶液中有H2SO3就一定有Fe2+,所以用品红稀溶液验证了H2SO3的存在就不必再验证Fe2+。
本题难度:一般
2、填空题 I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II (4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
参考答案:(1)2I- + CI2 = I2 + 2CI- (2) I2 + SO2 + 2H2O = 4H+ + SO42- + 2I- (3)SO2> I - >CI-
(4)NaOH溶液 2Al+ 2OH - + 2H2O = 2AlO2- + 3H2 ↑ (5) Na2CO3
本题解析:(1)在淀粉碘化钾溶液中通入少量氯气发生反应:2KI-+ Cl2 = I2 + 2KCl. I2遇淀粉变为蓝色。反应的离子方程式2I- + CI2 = I2 + 2CI-。(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发生反应:I2+ SO2+2H2O=2HI+H2SO4。所以蓝色逐渐消失。反应的离子方程式为I2 + SO2 + 2H2O = 4H+ + SO42- + 2I- .(3)根据氧化还原反应的规律,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。所以还原性:SO2> I ->CI- 。(4)Fe、Al都是比较活泼的金属。都能把酸中的氢置换出来。但Al能与强碱溶液发生反应,而Fe不能。故除去铁粉中混有铝粉的试剂是NaOH溶液。反应的离子方程式是2Al+ 2OH - + 2H2O = 2AlO2- + 3H2 ↑. (5) 2NaHCO3 Na2CO3+ CO2↑+ H2O,2mol的NaHCO3受热分解得到1mol CO2和1molH2O . 1mol H2O发生反应2Na2O2+2H2O=4NaOH+O2↑,消耗Na2O21mol 产生2mol NaOH .再发生反应2NaOH+ CO2= 2Na2CO3 +H2O。综合起来相当于发生2Na2O2+2CO2=2Na2CO3+O2消耗Na2O21mol,产生Na2CO31mol。故最后得到的固体为Na2CO3。
Na2CO3+ CO2↑+ H2O,2mol的NaHCO3受热分解得到1mol CO2和1molH2O . 1mol H2O发生反应2Na2O2+2H2O=4NaOH+O2↑,消耗Na2O21mol 产生2mol NaOH .再发生反应2NaOH+ CO2= 2Na2CO3 +H2O。综合起来相当于发生2Na2O2+2CO2=2Na2CO3+O2消耗Na2O21mol,产生Na2CO31mol。故最后得到的固体为Na2CO3。
考点:考查元素及化合物的性质、氧化性、还原性的比较、杂质的除去等知识。
本题难度:困难
3、填空题 分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O,据此作答:
(1)标出该反应中电子的转移方向和数目:
5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O
(2)该反应的氧化剂是 。
(3)该反应的氧化产物与还原产物的质量比是 。
(4)当反应生成0.3 mol Cl2时,则转移的电子的物质的量是 。
参考答案:(6分)(1)(2分)
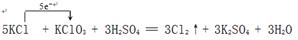 (双线桥表示也给分)
(双线桥表示也给分)
(2)KClO3(1分); (3)5∶1(1分); (4)0.5 mol(2分)
本题解析:根据方程式可知,在反应中氯化钾中氯元素的化合价从-1价升高到0价,氯酸钾中氯元素的化合价从+5价,降低到0价,所以氧化剂是氯酸钾。氧化产物和还原产物都是氯气,由于还原剂和氧化剂的物质的量之比是5:1,则反应的氧化产物与还原产物的质量比是5∶1。每生成3mol氯气,转移5mol电子,则当反应生成0.3 mol Cl2时,转移的电子的物质的量是0.5mol。
考点:考查氧化还原反应的有关计算和判断
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念判断即可。有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
4、填空题 向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为________________________________,
从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的化学方程式为______________________;
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
参考答案:(1)I- Fe2+ I2
(2)Fe2+、Fe3+、Cl- 5FeI2+6Cl2=5I2+2FeCl3+3FeCl2
(3)8.96 L
本题解析:(1)根据图像可知:首先I-被氧化,然后是Fe2+,所以还原性顺序为I->Fe2+>I2。(2)由图像可知n(I2)=0.1 mol,所以n(FeI2)=0.1 mol,n(I-)=0.2 mol。当通入0.12 mol Cl2即0.24 mol Cl时,I-全部被氧化,Fe2+有0.04 mol被氧化,所以溶液中的离子主要有:Fe2+、Fe3+、Cl-,其物质的量分别为0.06 mol、0.04 mol、0.24 mol,
I2为0.1 mol。
n(I2)∶n(FeCl3)∶n(FeCl2)=0.1∶0.04∶0.06=5∶2∶3
方程式为5FeI2+6Cl2=5I2+2FeCl3+3FeCl2。
(3)Fe2+ ~ 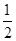 Cl2 I- ~
Cl2 I- ~ 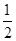 Cl2 I2~2IO3-~5Cl2
Cl2 I2~2IO3-~5Cl2
0.1 mol? 0.05 mol? 0.2 mol? 0.1 mol? x? 2x? 5x
由题意得:
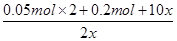 =8
=8
x=0.05 mol
V(Cl2)=(0.05 mol+0.1 mol+5×0.05 mol)×22.4 L·mol-1=8.96 L。
本题难度:一般
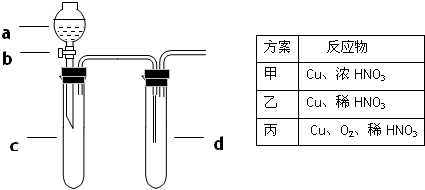
5、填空题 某兴趣小组设计出下图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是______.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸.c中反应的化学方程式是______;再由a向c中加2mL蒸馏水,c中的实验现象是______.
(3)上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是______,原因是______.
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,则c中加入的试剂是______
d中加入的试剂是______,实验现象为______;但此实验的不足之处是______.
参考答案:(1)因实验前要检查装置气密性,这是检查装置气密性的常见方法,故答案为:检查装置气密性;
(2)因铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,由a向c中加2mL蒸馏水,硝酸进行的稀释,反应变缓,同时因二氧化氮能与水反应:3NO2+2H2O=2HNO3+NO,c中气体颜色变浅,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应变缓,气体颜色变淡;
(3)铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,硝酸的利用率为12;
铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,硝酸的利用率为34;
此过程用方程式可表示为:2Cu+O2?△?.? 2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,故答案为:丙;耗酸量最少,无污染;
(4)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,利用KMnO4与浓盐酸反应:2KMnO4KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,
再利用产生的氯气与KBr溶液反应得到溴:Cl2+2KBr=2KCl+Br2,所以c中有黄绿色气体产生,d中溶液变为黄棕色,同时要注意尾气 吸收,
故答案为:KMnO4;KBr溶液(含Br-的溶液);c中有黄绿色气体产生,d中溶液变为黄棕色;没有处理尾气.
本题解析:
本题难度:一般