1、简答题 甲、乙、丙三位同学分别用如下甲、乙、丙三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
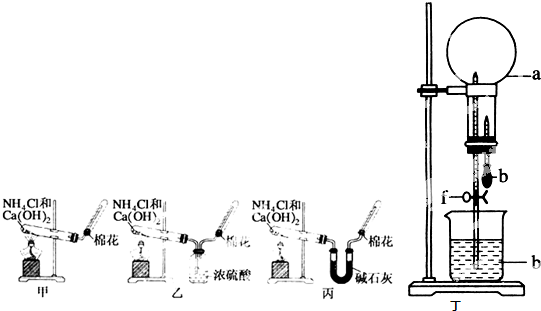
(1)三位同学制取氨气的化学方程式为:______.
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是______
A.氨气难溶于水 B.氨气极易溶于水
C.氨气密度比空气大D.氨气密度比空气小
E.氨气密度比水大F.氨气密度比水小
(3)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨气,收集不到氨气的主要原因是______(用化学方程式表示).
(4)检验氨气是否收集满的方法是______.
A.闻到有氨气逸出
B.棉花被气体冲出
C.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是______(填“甲”、“乙”或“丙”).
(6)要得到干燥的氨气可选用______作干燥剂.
A.碱石灰(CaO和NaOH的混合物)
B.浓硫酸
C.浓硝酸
D.氢氧化钠溶液
(7)用如图丁装置进行喷泉实验,烧瓶中已装满干燥氨气(标准状况),引发水向上喷的操作是______.
参考答案:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2△.CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2△.CaCl2+2NH3↑+2H2O;
(2)氨气易溶于水,不能用排水法收集,氨气密度比空气小,应用向下排空法收集,
故选:BD;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,反应方程式为:2NH3+H2SO4=(NH4)2SO4,故答案为:2NH3+H2SO4=(NH4)2SO4;
(4)氨气为碱性气体,与水反应生成NH3?H2O,电离子出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则氨气已满,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满,故选:C;
(5)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到,故答案为:丙;
(6)氨气是碱性气体所以能溶于酸,则氨气不能用酸干燥,氨气极易溶于水,所以氨气不能用水溶液干燥,故选A;
(7)打开止水夹,挤出胶头滴管中的水,氨气极易溶于水而使烧瓶内压强迅速减小,外界大气压不变,导致大气压大于烧瓶内压强,烧杯内水通过玻璃管进入烧瓶,从而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水.
本题解析:
本题难度:一般
2、填空题 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
(1)仪器A的名称是______;水槽中应盛放的是______;烧杯中盛放的是______;烧瓶中反应的化学方程式______;
(2)在收集氯气时,应______.(填如何控制a.b)
(3)若要制得标准状况下的Cl20.672L,理论上需要MnO2的质量是______g被氧化盐酸的物质的量______mol
(4)若要增大新制氯水中HClO的浓度可加入______
A.食盐B.水C.CaCO3D.NaOH.

参考答案:(1)根据仪器特点可知A为分液漏斗;因为氯气有毒,可污染空气,要进行尾气吸收,并且氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收尾气中,烧杯中盛放氢氧化钠溶液收,集完毕,关闭a,打开b,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气;Cl2+2NaOH=NaCl+NaClO+H2O;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,实验室常用二氧化锰和浓盐酸在加热条件下生成氯气,反应的化学方程式为MnO2+4HCl△.MnCl2+Cl2↑+2H2O,
故答案为:分液漏斗;饱和食盐水;氢氧化钠溶液;MnO2+4HCl△.MnCl2+Cl2↑+2H2O;
(2)氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,收集时,应关闭b,打开a,故答案为:关闭b,打开a;
(3)n(Cl2)=VVm=0.672L22.4L/mol=0.03mol;
生成0.03molCl2参加反应的HCl的物质的量为x,反应的二氧化锰物质的量为Y;
MnO2+4HCl△.MnCl2+Cl2↑+2H2O
1 4 1
y x 0.03mol
x=0.12mol
y=0.03mol
被氧化的HCl的物质的量=0.12mol×12=0.06mol.
理论上反应的二氧化锰质量=0.03mol×87g/mol=2.61g;
故答案为:2.61;0.06;
(4)氯水中氯气和水反应生成盐酸和次氯酸,Cl2+H2O=HClO+HCl,
A、食盐加入,增大氯离子浓度,平衡左移,次氯酸浓度减小,故A不符合;
B、水加入平衡状态物质浓度减小,次氯酸浓度减小,故B不符合;
C、加入碳酸钙和盐酸反应促进平衡正向进行,次氯酸浓度增大,故C符合;
D、加入氢氧化钠会和盐酸、次氯酸发生反应,次氯酸浓度减小,故D不符合;
故答案为:C.
本题解析:
本题难度:一般
3、简答题 下列装置用于二氧化锰和浓盐酸在加热条件下反应制取纯净、干燥的氯气.
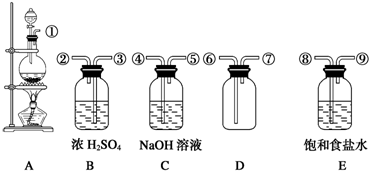
(1)在装置A~E中,有①~⑨个接口,用编号表示仪器的导气管连接顺序依次为______.
(2)B瓶中浓H2SO4的作用是______,E瓶盛有的饱和食盐水的作用是______.
(3)C瓶中盛有NaOH溶液是为了______,其反应的化学方程式是______.
参考答案:(1)实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,
故答案为:①⑧⑨③②⑥⑦④⑤;
(2)用以上方法制氯气,因HCl和H2O的挥发,逸出的氯气中常混有少量氯化氢和水蒸气,若需收集纯净、干燥的氯气,就应进行净化.可依次通过盛有饱和食盐水和浓硫酸的洗气瓶,使氯化氢溶解于饱和食盐水(氯气在饱和食盐水中溶解度大大降低),水蒸气被浓硫酸吸收,经这样的净化处理,氯气就较纯净了.
故答案为:除去水蒸气(干燥氯气);除去HCl杂质气体;
(3)氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,氯气与NaOH反应生成氯化钠和次氯酸钠,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O.
本题解析:
本题难度:一般
4、实验题 欲制无水氯化铝并保存备用。现有仪器如下图所示,并有浓盐酸、水、固体烧碱、铝粉、二氧化锰、浓硫酸、碱石灰(主要成分为CaO, NaOH)、食盐固体等八种试剂。
设计的制取过程是:制氯气 → 净化和干燥氯气 → 制氯化铝
查资料得知:无水AlCl3极易与水作用而变质,AlCl3易升华
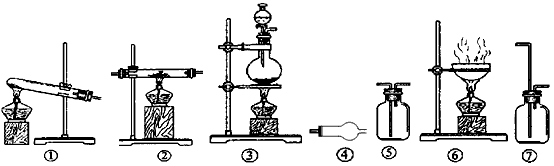
请回答下列问题:
(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(可以重复使用)。仪器编号______、______、______、______、______、 ④
(2)写出实验过程中有关反应的化学方程式(任意2个)。
________________________、______________________________
(3)以上连接装置中最后连接④的作用是____________________________________
参考答案:(1)③ 、⑦ 、⑤ 、② 、⑤
(2)MnO2+4HCl MnCl2+Cl2↑+2H2O;2Al+3Cl2==2AlCl3或Cl2+2NaOH==NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O;2Al+3Cl2==2AlCl3或Cl2+2NaOH==NaCl+NaClO+H2O
(3)吸收过量的Cl2,防止空气中的水蒸气进入试管中使AlCl3变质
本题解析:
本题难度:一般
5、简答题 某研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,锰化合物的还原产物都是MnCl2(如:K2MnO4+8HCl═MnCl2+2Cl2↑+2KCl+4H2O).他们又进行了以下一些有关定量的实验,按要求填空或计算(气体体积都折合成标准状况).
(1)称取了15.8g?KMnO4粉末,放在试管中加热充分反应后,收集到气体的体积是______;另取31.6g?KMnO4粉末和足量盐酸反应,收集到气体体积是______.
(2)将31.6g?KMnO4粉末加热一段时间,收集到1.12L气体后停止加热,冷却后放入足量的浓盐酸再加热,又收集到气体体积是______.
(3)将a?mol?KMnO4粉末加热一段时间,收集到V1L气体后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2L.则V2=______(用a、V1表达).
参考答案:(1)15.8g?KMnO4粉末物质的量=15.8g158g/mol=0.1mol,放在试管中加热充分反应,
化学方程式为2KMnO4?加热?.?K2MnO4+MnO2+O2↑,生成氧气物质的量为0.05mol,
所以氧气的体积在标准状况下=0.05mol×22.4L/mol=1.12L;
取31.6g?KMnO4粉末和足量盐酸反应生成的气体是氯气,31.6g?KMnO4粉末物质的量=31.6g158g/mol=0.2mol;
反应的化学方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,根据反应中的定量关系2KMnO4~5Cl2,
0.2mol高锰酸钾反应生成0.5mol氯气,标准状况下的体积=0.5mol×22.4L/mol=11.2L;
故答案为:1.12 L 11.2 L
(2)31.6g?KMnO4粉末加热一段时间,收集到1.12L气体后停止加热,根据化学方程式,
2KMnO4?加热?.?K2MnO4+MnO2+O2↑,此时生成的气体是氧气0.05mol,生成锰酸钾0.05mol,二氧化锰0.05mol,分解的高锰酸钾0.1mol,剩余高锰酸钾0.1mol;根据氧化还原反应的电子守恒,这些氧化剂得到电子,锰元素最终变为锰离子,和浓盐酸反应,氯离子失去电子变为氯气,得失电子是相同的,根据电子守恒计算;
得到电子的物质:KMnO4~Mn2+~5e-,K2MnO4~Mn2+~4e-,MnO2~Mn2+~2e-,
?0.1mol? ?0.5mol?0.05mol?0.2mol? 0.05mol? 0.1mol
共得到电子物质的量=0.1mol+0.2mol+0.5mol=0.8mol;
失电子的物质是氯化氢:2Cl-~Cl2~2e-?
?0.4mol? 0.8mol
所以生成的氯气标准状况下的体积=0.4mol×22.4L/mol=8.96L
故答案为:8.96L;
(3)将a?mol?KMnO4粉末加热一段时间,收集到V1?L气体为氧气后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2?L
根据(2)的分析可知高锰酸钾得到的电子最终变为锰离子,其中有一部分生成了氧气,其他变化生成了氯气,依据氧化还原反应中的电子守恒得到:
失去电子的变化:KMnO4~O2~4e-? 2Cl-~Cl2~2e-?
? V122.4L/mol? 4V122.4L/mol
得到电子的变化:KMnO4~Mn2+~5e-,除去生成氧气得到的电子,锰元素变为锰离子得到的电子全部生成氯气,所以生成氯气得到的电子物质的量=5amol-4V122.4L/mol
?由电子守恒可知:2Cl-~Cl2~2e-?
生成氯气在标准状况下的体积=(5amol-4V122.4L/mol)×12×22.4L/mol=56a-2V1
故答案为:56a-2V1
本题解析:
本题难度:一般