1、实验题 乙醇在浓硫酸作用下制取乙烯时,浓硫酸容易使乙醇碳化,用氧化铝替代浓硫酸重新设计实验如下。
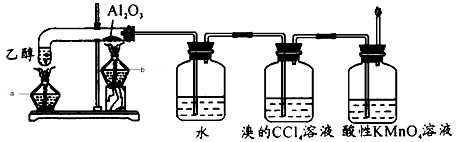
请回答:
(1)开始加热时应先点燃酒精灯_____(填“a”或“b”)。
(2)水的作用是______________,可以将该瓶中收集到的物质分离的常用方法是___________。
(3)可利用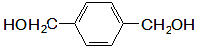 和乙烯合成世界上产量最大的合成纤维(PET), 其结构简式为:
和乙烯合成世界上产量最大的合成纤维(PET), 其结构简式为: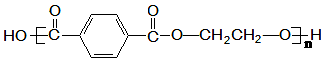 。
。
按下列示例写出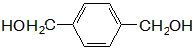 和乙烯合成PET的反应流程图(其他原料自选,并注明必要的反应条件)。反应流程图例如:
和乙烯合成PET的反应流程图(其他原料自选,并注明必要的反应条件)。反应流程图例如: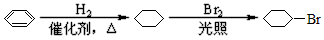
___________________________________________
参考答案:(1)b
(2)吸收乙醇;蒸馏 (3)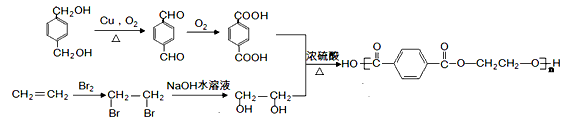
本题解析:
本题难度:困难
2、简答题 某校化学兴趣小组的同学利用漂白粉与稀硫酸在加热条件下反应制取Cl2,其反应的化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O.以下是制取Cl2并验证其部分性质的实验装置.

试回答下列问题:
(1)请在上图(右上装置中)选择满足实线框图I的气体发生装置:______(填代号);
(2)实验装置Ⅲ的作用是______;
(3)一段时间后,装置Ⅲ的溶液仍呈强碱性,其中肯定存在Cl-、OH-和SO42-,请设计实验探究该吸收液中可能存在的其它阴离子(不考虑空气中CO2的影响).
①提出合理假设:假设1:只存在SO32-;?假设2:只存在ClO-;?假设3:______
②设计实验方案进行实验,请写出实验步骤以及预期现象和结论.实验试剂:3mol?L-1?H2SO4、1mol?L-1?NaOH、0.01mol?L-1?KMnO4、淀粉KI溶液、紫色石蕊试液. | 实验步骤 | 预期现象和结论
步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中.
/
步骤2:______
______?
步骤3:______
______?
参考答案:(1)反应物是固体和液体,反应条件是加热,所以应选择固、液混合加热型装置,故答案为:b;
(2)二氧化硫和氢氧化钠反应生成亚硫酸钠,氯气有毒,所以不能直接排空,氯气和亚硫酸钠、氢氧化钠反应转化为无毒物质,Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,所以该装置的作用是吸收多余氯气,防止污染大气.
故答案为:吸收多余氯气,防止污染大气;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设:
假设1、溶液中可能存在只存在SO32-,
假设2、溶液中只存在ClO-,
假设3、既不存在SO32-也不存在ClO-.
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1?H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;
在A试管中滴加0.01mol?L-1KMnO4溶液,若紫红色褪去,证明有SO32-,否则无.
在B试管中滴加紫色石蕊试液,若先变红后褪色,证明有ClO-,否则无;
故答案为:既不存在SO32-,也不存在ClO-;
实验步骤预期现象和结论?步骤2:向A试管中加入O.Olmol?L-1
KMnO4溶液,振荡试管.(1)若溶液褪色,则假设1成立;
(2)若不褪色,则假设2或假设3成立.步骤3;向B试管中滴加紫色石蕊试液.(1)若先变红后褪色,则假设2成立;(2)若不褪色,则假设1或假设3成立.
本题解析:
本题难度:一般
3、填空题 为了讲授“氯气的性质和用途”,李老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行教学.
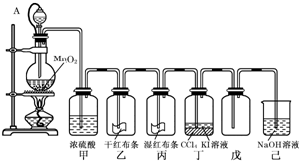
试回答下列问题:
(1)乙中的现象是______丙中的现象是______甲的作用是______己的作用是______
(2)写出己中反应的离子方程式:______.
(3)写出漂白液在生活中消毒杀菌的离子方程式:______.
参考答案:(1)氯气没有漂白性,有漂白性的是氯气和水反应生成的次氯酸,所以乙中的现象是:干燥的红布条不褪色;丙中的现象是:湿润的红色布条褪色;甲的作用是:除去氯气中的水蒸气,己的作用是:吸收过量的氯气,防止污染环境,
故答案为:干燥的红布条不褪色;湿润的红色布条褪色;除去氯气中的水蒸气;吸收过量的氯气,防止污染环境;
(2)氯气通入氢氧化钠溶液发生歧化反应生成次氯酸钠和氯化钠和水的离子方程式为:Cl2+2OH-=NaCl+ClO-+H2O,
故答案为:Cl2+2OH-=NaCl+ClO-+H2O;
(3)漂白液中的次氯酸根离子与空气中的二氧化碳和水反应生成具有强氧化性的次氯酸,次氯酸具有杀菌消毒作用离子方程式是:2ClO-+CO2+H2O=CO32-+2HClO,
故答案为:2ClO-+CO2+H2O=CO32-+2HClO.
本题解析:
本题难度:一般
4、实验题 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题
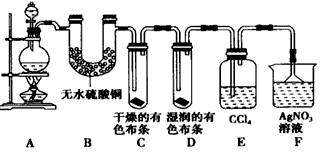
(1)下列方法中,可制得Cl2的正确组合是_________。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式_____________________。
(3) ①装置B的作用是__________________;②装置C和D出现的不同现象说明的问题是_________;③装置E的作用是__________________。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置_____与______之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为_________。
A.湿润的淀粉KI试纸 B.浓硫酸 C.湿润的红色布条 D.饱和的食盐水
参考答案: (1)D
(2)4H++ 2Cl-+ MnO2 2H2O + Cl2↑+ Mn2+ 2H2O + Cl2↑+ Mn2+
(3)①证明有水蒸气产生;②Cl2无漂白性,次氯酸有漂白性;③吸收Cl2
(4)E;F;AC
本题解析:
本题难度:一般
5、选择题 下面是实验室制取氨气的装置和选用的试剂,其中错误的是
[? ]
A. 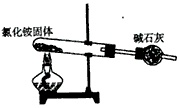
B. 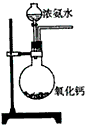
C. 
D. 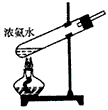
参考答案:AC
本题解析:
本题难度:简单
|