1、选择题 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)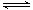 2HI(g);(正反应放热),当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是(?)
2HI(g);(正反应放热),当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是(?)
A.容器内气体颜色变深,平均相对分子质量变小
B.平衡不移动,混合气体密度增大
C.改变条件前后,速度图象为(如下图)
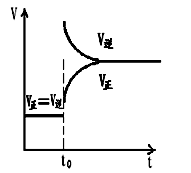
D.H2转化率增大,HI平衡浓度变小
2、选择题 在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)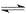 Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
温度℃
| 25
| 80
| 230
|
平衡常数
| 5×104
| 2
| 1.9×10-5
|
?
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)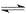 Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
3、计算题 将10molA和5molB放入10L的真空箱中,某温度下发生反应: 3A(气)+B(气)==2C(气)在最初0.2s内,消耗A的平均速率为0.06mol/L·s,则在0.2s时,箱中有________molC生成。
4、计算题 消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ?;在T ℃时,该反应的平衡常数K = ?。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是?(填序号)。
a.混合气体的密度? b.混合气体的压强
c.正反应速率? d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g)?△H =" —180.5" kJ·mol-1
2H2O(l) =2H2(g) + O2(g)?△H =" +571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
?。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g)
 ?2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
?2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

① 该反应的?H?0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2?条件下达到平衡过程中的变化曲线(并作相应标注)。
5、选择题 在密闭容器中冲入4mol?SO2和3mol?O2?一定条件下建立平衡2SO2(g)+O2(g)?2SO3(g)△H=-Q?KJ/mol,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A.1.8Q?KJ
B.2Q?KJ
C.Q?KJ
D.0.9Q?KJ